GIOCHI DELLA CHIMICA 2013 FASE REGIONALE CLASSE C
1. Indicare quale tra le seguenti tecniche analitiche NON è adatta per la determinazione di cationi di metalli pesanti presenti anche in traccia:
A) ICP – massa
B) voltammetria di stripping anodico
C) voltammetria a onda quadra
D) spettroscopia IR
soluzione
la spettroscopia IR non è utilizzabile per l’analisi dei metalli in quanto con questa tecnica si misurano le vibrazioni elettroniche di gruppi atomici o molecole. Quando un fotone infrarosso colpisce una molecola o un gruppo atomico si possono verificare transizioni dei livelli vibrazionali e rotazionali e sono proprio queste transizioni che vengono misurate e valutate e quindi la tecnica è inadeguata per l’analisi dei metalli.
la tecnica ICP-MS dall’inglese inductively coupled plasma mass spectrometry, si fonda sull’utilizzazione della spettrometria di massa assieme al plasma accoppiato induttivamente. Si tratta di una tecnica in grado di determinare e misurare sostanze metalliche anche in parti per miliardo (ppb) ed utilizza il plasma (altissime temperature) per portare i metalli allo stato di nucleo staccandone completamente gli elettroni. I nuclei formati, vengono inviati ad uno spettrometro di massa che attraverso un campo magnetico riesce a separarli in funzione della loro massa.Questa tecnica permette quindi anche la separazione e l’analisi quantitativa degli isotopi di un atomo.
La voltammetria è una tecnica analitica che si basa sulla misura della corrente che passa attraverso un elettrodo sottoposto ad una differenza di potenziale e che è immerso in una soluzione contenente specie chimiche che si possono ridurre o ossidare. Quando la specie chimica raggiunge l’elettrodo e vi si scarica si genera una corrente che viene opportunamente misurata. L’elettrodo, può essere costituito da materiali di vario tipo e possiede generalmente una superficie molto piccola in modo da assumere rapidamente il potenziale che gli viene applicato.Se l’elettrodo è una goccia di mercurio che cade ritmicamente da un capillare allora la metodica viene definita Polarografia.L’applicazione più diffusa della voltammetria è la misura quantitativa di specie chimiche che si ossidano o si riducono, quindi ovviamente, è utilizzabile per l’analisi dei metalli anche a livelli inferiori ai μg/l.
2. Una bombola a 300 °C con una pressione di 219,9 kPa contiene ammoniaca dissociata per l’89% secondo la reazione
2 NH3 (g) → N2 (g) + 3 H2 (g)
Calcolare le pressioni parziali in kPa dei componenti della miscela gassosa:
A) p(NH3) = 127,7; p(N2) = 71,78; p(H2) = 152,0
B) p(NH3) = 12,77; p(N2) = 51,78; p(H2) = 155,0
C) p(NH3) = 18,70; p(N2) = 54,78; p(H2) = 125,0
D) p(NH3) = 2,77; p(N2) = 59,78; p(H2) = 115,0
soluzione
2 NH3 (g) → N2 (g) + 3 H2 (g)
2(1-α) α 3α e dividendo per 2 si ha un numero di moli totali =1 -α +α/2 +3/2α =1+ α
la pressione parziale di N2 è p = ( α/2/ 1+ α ) x 219,9 = (0,445 /1,89) x 219,9 = 51,78
la pressione parziale di NH3 p= (1-α / 1+ α) x 219,9 = (1-0,89/1,89 ) x 219,9 = 12,77
la pressione parziale di H2 p = (3/2 α / 1+ α) x 219,9 = (1,33/1,89 ) x 219,9 = 155
Risposta corretta B
3. È noto che il legame C-H si scinde circa 5 volte più velocemente del legame C-D (deuterio) e circa 8 volte più del legame C-T (trizio). Indicare il meccanismo più probabile nella sostituzione elettrofila aromatica, se in essa non si osserva alcun effetto isotopico significativo:
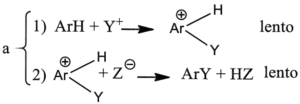
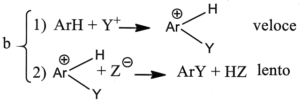
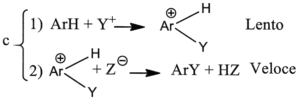

A) a
B) b
C) e
D) d
soluzione
L’effetto isotopico è un effetto che si osserva quando un atomo di un particolare legame viene sostituito da un suo isotopo che forma lo stesso tipo di legame. La sostituzione modifica la massa dell’atomo e quindi l’ influenza si osserva sulla velocità della reazione cui partecipa l’isotopo. Per esempio l’effetto dovuto alla sostituzione dell’H del legame C-H col deuterio D o col Tritio nell’anello benzenico è la diminuzione della velocità delle reazione di sostituzione. Nel caso in esame, non essendoci effetto isotopico, la formazione del composto intermedio è una reazione lenta mentre la reazione finale diviene veloce.
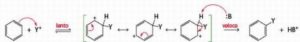
la risposta corretta è C
4. Individuare la temperatura minima alla quale il carbonato di calcio può trasformarsi in calce viva secondo la reazione in condizioni standard:
CaCO3 (s)→ CaO (s) + CO2 (g)
Si ammetta che l’entalpia e l’entropia di reazione siano indipendenti da T.
ΔH0f (CaCO3 (s)) = -1206,9 kJ mol–1
ΔH0f (CaO (s)) = -635,09 kJ mol–1
ΔH0f (CO2 (g)) = -393,51 kJ mol–1
S0 (CaO (s)) = 39,8 J K–1 mol–1
S0 (CO2 (g)) = 213,7 J K–1 mol–1
S0 (CaCO3 (s)) = 92,9 J K–1 mol–1
A) > 837 °C
B) < 800 °C
C) > 1110 °C
D) < 1110 °C
soluz
La reazione CaCO3(s) → CaO(s) + CO2(g)
∑ΔΗprodotti – ∑ΔΗreagenti = ( -635,09 kJ mol–1 + -393,51 kJ mol–1) – ( -1206,9 kJ mol–1)
ΔΗ = + 178,3 kJ/mol
è una reazione endotermica con un ΔH° = + 178,3 kJ/mol
La reazione deve essere quindi condotta ad alta temperatura e per conoscere la temperatura più idonea ricordiamo che
ΔS°sis = Σ S°prodotti – Σ S°reagenti
cioè ΔS°sis = S°CaO + S°CO2 – S°CaCO3
ΔS°sis = (39,8 J K–1 mol–1 + 213,7 J K–1 mol–1) – 92,9 J K–1 mol–1 = + 160.6 J/mol K
sappiamo inoltre che la variazione di entropia totale è data dalla somma tra la variazione di entropia del sistema e la variazione di entropia dell’ambiente:
ΔS°amb = – ΔH°/T = – 179000 /T
La variazione di entropia totale è quindi data da:
ΔS°tot = ΔS°sis + ΔS°amb = 160,6 – 179000/T
Affinché la reazione sia spontanea è necessario che ΔS°tot > 0
Tuttavia, alla temperatura di 25°C (298 K )
ΔS°tot = ΔS°sis + ΔS°amb = 160,9 – 179000/298 = – 439.7 J/mol K
pertanto essendo ΔS°tot <0 la reazione non è spontanea.
Per calcolare a quale temperatura minima avviene la reazione deve essere ΔS°tot > 0 quindi
160,9 – 179000/T > 0 160,9 > 179000/ T e moltiplicando ambo i membri per T si ha
160,9 T > 179000
Da cui T > 1112 K = 839 °C
Bisogna anche ricordare che a temperatura ambiente l’equilibrio della reazione è spostato a sinistra e la pressione di equilibrio del biossido di carbonio costituisce solo una piccola frazione rispetto alla pressione parziale del biossido di carbonio contenuto nell’aria. Solo a temperature al di sopra di 550 °C la pressione della CO2 prodotta inizia a essere maggiore della pressione esercitata dalla CO2 dell’aria e quindi solo a temperature maggiori di 550 °C il carbonato di calcio inizia a decomporsi e l’equilibrio si sposta nettamente verso destra.
La risposta corretta è A
5. Indicare il differenziale che, per un gas ideale, assume valore nullo.
A) (dg/dt)p
B) (dG/dp)T
C) (dU/dv)T
D) (dU/dT)P
soluzione
Poiché è noto che la temperatura è espressione dell’energia interna di un sistema, ogni variazione di temperatura si riflette sull’energia cinetica delle molecole che, pertanto, aumenta all’aumentare della temperatura. Si deduce quindi che se la temperatura viene mantenuta costante, l’energia di un sistema non può variare e quindi (dU/dv)T deve necessariamente essere zero.
risposta corretta C
6. Una soluzione solida è stata ottenuta mescolando 1,00 mol di Fe e 1,00 mol di C a 298 K. Se si considera la soluzione a comportamento ideale, l’entropia di mescolamento vale:
A) R ln 2
B) R ln4
C) -R ln 2
D) zero
soluzione
quando due elementi o composti si miscelano per formare un soluzione solida, l’entropia del sistema aumenta in quanto aumenta il disordine dovuto alle numerose possibilità che hanno i due (0 più) elementi di distribuirsi nello spazio.L’ entropia di mescolamento di due componenti A e B nel formare una soluzione è
ΔSmis = – R nAlnΧA – R nBlnXB = -R(nAlnΧA + nBlnXB)
dove con nA e nB indichiamo il numero di moli di A e di B;
e con ΧA la frazioni molare di A = nA /(nA + nB)
e con XB la frazione molare di B = nB/(nA + nB).
Da quanto detto si ha
nA = nB = 1 ΧA = ΧB = ½
pertanto
ΔSmisc = – R (ln1/2 + ln1/2) = – 2R (ln1/2 + ln1/2) = – 2R ln1/2
ΔSmisc = 2R ln2
Poiché la variazione di entropia si riferisce a 2 moli di soluzione, per 1 mole di soluzione che si forma l’ aumento di entropia è pari a R ln2.
Risposta corretta A
7. Riferendosi alla soluzione solida Fe-C a comportamento ideale del precedente esercizio, l’entalpia associata al processo di mescolamento, alla T indicata, vale:
A) zero
B) RT ln2
C) -RT ln 2
D) -RT ln 4
soluzione
consideriamo due sequenze nel miscelamento di XA moli di A ed XB moli di B
la prima mettere insieme i due atomi
la seconda mescolarli per formare una soluzione omogenea.
nella prima sequenza si ha G1=xAGA + xBGB
dopo la seconda sequenza si ha G2 = G1 + ΔGmix dove ΔGmix è la variazione di energia libera della miscela
ΔGmix = ΔHmix −TΔSmix ed analogamente
ΔHmix = H2 − H1
l’entalpia di due elementi A e B in una miscela meccanica le cui entalpie sono HA ed HB è data da
H = xAHA + xBHB
in una soluzione ideale le interazioni tra gli atomi A-A,B-B ed A-B sono identiche per cui nella formazione di una soluzione solida l’eccesso di entalpia (entalpia di miscela) è ΔHmisc = 0 da cui si ha anche ΔGmisc = −TΔSmisc
risposta corretta A
8. Indicare quale delle seguenti tecniche analitiche risulta distruttiva per il campione da analizzare:
A) FT-IR
B) ICP (emissione al plasma)
C) HPLC
D) UV-vis
soluzione
la sola metodica in cui il campione viene distrutto è l’ ICP in quanto l’atomo analizzato viene determinato dopo la sua trasformazione allo stato di plasma. Gli altri metodi analitici lasciano inalterato il campione.
risposta corretta B
9. Studiando la reazione dell’emoglobina (Hb) con il monossido di carbonio:
4 Hb + 3 CO → Hb4(CO)3
si ottengono i seguenti dati che permettono di stabilire la corretta legge di velocità della reazione:
Prova [Hb], M [CO],M Velocità iniziale di scomparsa di Hb,
prova [Hb] [CO] vel.scomparsa Hb
1 1,50 ·10–6 1,00 ·10–6 9,20 ·10–7
2 3,00 ·10–6 1,00 ·10–6 1,84 ·10–6
3 3,00 ·10–6 3,00 ·10–6 5,52 ·10–6
A) v = k [Hb] [CO]
B) v = k [Hb] [CO]2
C) v = k [Hb]2 [CO]
D) v = k [Hb] [CO]3
soluzione
per rispondere al quesito basta calcolare il valore di K in ognuna delle formule che forniscono la velocità A-B e C : se k rimane costante allora la cinetica è quella data dalla formula utilizzata. Per esempio nel caso della formula A cioè v = k [Hb][CO] si ha k= V / [Hb][CO]
9,20 ·10–7/ 1,50 ·10–6 x 1,00 ·10–6 = 6,1 x 1o5
1,84 ·10–6/ 3,00 ·10–6 x 1,00 ·10–6 = 6,1 x 1o5
5,52 ·10–6/ 3,00 ·10–6 x 3,00 ·10–6 = 6,1 x 1o5
dai risultati si osserva che il valore di k calcolato dai dati è costante, quindi l’espressione della velocità è la formula A cioè si tratta di una velocità del secondo ordine.
10. Un idrocarburo gassoso CxHy (55 mL) viene mescolato con O2 (260 mL) a temperatura ambiente e fatto esplodere per innesco con una fiamma
CxHy + (x + y/4) O2 → x CO2 + (y/2) H2O
Dopo raffreddamento alla temperatura di partenza il volume della soluzione gassosa è di 177,5 mL. Tale volume, dopo assorbimento su KOH, si riduce a 67,5 mL. Determinare la formula dell’idrocarburo:
A) C7H8
B) C6H6
C) CH4
D) C2H6
soluzione
67,5ml corrispondono a 0,0675 L di H2O mentre il resto, 177,5ml-67,5ml =110 ml =0,110L è assorbito da KOH ed è costituito da CO2.
calcoliamo i grammi di H2O e di CO2 ottenuti ricordando che PV=g/PM RT quindi g = PVx PM /RT
poiché t ambiente = 20° e P= 1 atm si ha per l’H2O g=1×0,0675 x18 /24,0 = 0,05 g di H2O
per CO2 si ha g= 1 x 0,110 x 44/24,0 =0,2 g CO2
i grammi di H contenuti nell’H2O sono 18:2 =0,05:x X= 0,0055 g H cioè 0,0003 moli H
i grammi di C contenuti in CO2 sono 44:12 = 0,2 😡 X= 0,0054 g C cioè 0,0001 moli C
dividendo per il numero di moli più piccolo si ha C=1 ed H= 3
la formula minima è C1H3 la formula del composto è C2H6
11. Un partecipante alle Olimpiadi della Chimica deve studiare la cinetica della reazione tra acido ascorbico (1,01 ·10–2 M, in forte eccesso) e ferricianuro di potassio (5,22 ·10–4 M) a pH 1,22. In particolare deve determinare dopo quanto tempo la soluzione, che inizialmente ha un’assorbanza di 4,77 ·10–1, raggiunge un’assorbanza di 3,37 ·10–2.
Egli sa che la cinetica della reazione, essendo l’acido ascorbico in forte eccesso, è di pseudo primo ordine rispetto al ferricianuro e ha una costante di velocità pari a 8,99 ·10–3 s–1. Egli calcola che il tempo richiesto è vicino a:
A) 300 s
B) 420 s
C) 600 s
D) 360 s
soluzione
per una generica reazione del tipo a A + b B ¨ c C + d D
la velocità non è altro che la variazione nel tempo di uno qualsiasi dei componenti della reazione ( uno dei reagenti o uno dei prodotti). La velocità di una reazione viene sempre determinata sperimentalmente ed è proporzionale al prodotto della concentrazione di A elevato al suo coefficiente stechiometrico a per la concentrazione di B elevata al suo coefficiente stechometrico b .
La somma a+b. è definita ordine della reazione
per una reazione A→ X
la reazione è del primo ordine e le velocità è
–d[A] / dt = d[X] dt= v = = k[A]
per la reazione del secondo ordine
A +B → X + Y
-d[A] /dt = – d[B]/dt = d[X] dt = d[Y] /dt
v = k[A][B]
per una reazione sempre del secondo ordine del tipo A+A → X oppure 2A→ X
la velocità è data da V= k[A]²
quando in una reazione del secondo ordine la concentrazione iniziale di A è molto maggiore di quella di B allora [B] si può ritenere costante e la reazione è definita di pseudo primo ordine e la velocità è
V= K[A]iniz
per risolvere il quesito posto ricordiamo che
 da cui
da cui
 da cui integrando
da cui integrando


 che riscriviamo
che riscriviamo
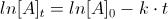 da cui si ottiene
da cui si ottiene
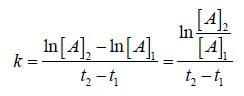
nel caso specifico, t1 è il tempo zero iniziale (t1=0) pertanto possiamo calcolare t2 ricordando che le assorbanze sono proporzionali alle concentrazioni per la legge di Lambert e Beer A=K C
T2 x 0,00899= ln 0,477 – ln 0,0337
t2 = 0,74 – (-3,41) / 0,00899 da cui t2 = 3,41-0,74/0,00899 = 297 sec ≅ 300 sec
la risposta corretta è A
12. Dato l’acido NCCH2COOH, indicare l’ibridazione dei suoi atomi di carbonio da sinistra a destra:
A) sp2, sp3, sp2
B) sp, sp2, sp2
C) sp2, sp3, sp3
D) sp, sp3, sp2
soluzione
il gruppo NC possiede un triplo legame quindi sia N che C posiedono un’ibridizzazione SP
nel gruppo CH2 il C è legato a 4 atomi di cui 2 atomi di idrogeno e due atomi di C pertanto è ibrido SP3
il carbonio del gruppo COOH forma con uno degli atomi di ossigeno il carbonile CO in cui sia il carbonio che l’ossigeno sono ibridi SP2
infine, l’atomo di ossigeno del gruppo OH è ibrido SP3.
13. Indicare il numero di isomeri possibili di formula C5H10:
A) 6
B) 12
C) 13
D) 14
soluzione
gli isomeri di struttura possono derivare da una catena lineare in cui vi è un doppio legame CH3-CH=CH- CH2-CH3 in varie posizioni es 1-2 2-3 (e relativi isomeri cis -trans o meglio Z-E) oppure da isopropilbutene(2 isomeri) un ciclopentano, dimetil ciclopropano, metil ciclobutano
in totale si possono scrivere 13 isomeri
risposta corretta C
14. Indicare, nell’ordine, la massa di Ag2SO4 che si scioglie in 1,00 L di H2O e nello stesso volume di una soluzione contenente 4,20 ·10–1 mol di Na2SO4.
Si assuma che il volume non vari all’aggiunta dei sali nell’acqua. Il calcolo è stato fatto introducendo un’approssimazione possibile. KPS (Ag2SO4) = 1,7 ·10–5.
A) 8,75 ·10–1 g; 4,5 g
B) 5,05 g; 9,92 ·10–1 g
C) 2,5 g; 1,75 ·10 g
D) 4,5 g; 8,75 g
soluzione
la solubilità in acqua si calcola dal Kps = [Ag+]² [SO4-2] 1,7 x 10-5 = (2S)² x S = 4 S³
1,7 x 10-5 /4 = S³ da cui S³= 4,2 x 10-6 S= 1,61×10-2 moli/L cioè 1,61×10-2 x 311,8= 5,0 g/L
la solubilità in Na2SO4 0,42 M si ottiene sempre da Kps = (2S)² x (S+ 0,42)
( ione a comune che si aggiunge a quello proveniente dalla dissociazione di Ag2SO4)
da cui 4S² x (S +0,42) =Kps quindi 4S³ +1,68 S² – 1,7 x 10-5 = 0
da cui risolvendo si ha S= 3,17 x 10-4 moli/ cioè S= 3,17 x 10–4 x 311,8 = 0,99 g/l
risposta corretta B
15. Una reazione chimica si svolge in un recipiente cilindrico che ha la base di 100 cm² e
dotato di pistone a tenuta, libero a un’estremità. Per effetto della reazione, il pistone si alza di 10,0 cm. Indicare il lavoro eseguito dal sistema, sapendo che la pressione esterna è di 100 kPa.
A) -100 J
B) 1280 J
C) -130 kJ
D) 180 kJ
soluzione
il lavoro compiuto dal sistema contro una pressione esterna P è :
L =- P(V2-V1) = -PΔV
la variazione di volume si calcola dal volume del cilindro = base x altezza = 100 c² x 10 cm =1000 c³ = 1 litro
Pertanto L= – 100 x 1 = -100 J
risposta esatta A
16. La capacità termica dell’aria è molto minore di quella dell’acqua. Perciò, per modificare la
temperatura dell’aria, bastano quantità relativamente modeste di energia termica. Questo contribuisce a spiegare le forti escursioni termiche nelle regioni desertiche. Sapendo che la capacità termica dell’aria a temperatura e pressione ambiente è di circa 21,0 J K–1 mol–1, indicare l’energia che occorre per innalzare di 10 °C la temperatura di una stanza di dimensioni 5,50 m · 6,50 m · 3,0 m che si trovi a 22 °C. Quindi, trascurando le perdite, individuare il tempo necessario affinché una stufa da 1,50 kW realizzi l’aumento di temperatura:
A) 940 s
B) 320 s
C) 620 s
D) 420 s
soluzione
la stanza ha un volume di 5,5×6,5x 3=107,25 m³ che corrisponde al volume di aria.
alla pressione di 1 atmosfera e 22°C si ha dalla PV=nRT n=V/RT = 107,25x 1000 litri /24,2 =4428,15 moli
1 mole di aria a 22 gradi pesa 25,3, g pertanto la quantità in kg di aria è 4428,15 x 25,3 = g = 112,033 kg
se per aumentare di 10 gradi la temperatura di 1 Kg o corrono Q= 21 x10 =210 J per 107,25 ne occorrono
112,033 x 210 =23526,93 J
sapendo che la stufa ha una potenza di 1,5KW e che
potenzain W =Q/tempo si ha tempo= Q/W 23526,93 /1500 =15,68 x 60= 941 sec
risposta corretta A
17. Fornendo, a pressione costante, un’energia di 229 J a 3,00 moli CO2 (g), la temperatura del campione sale di 2,06 K. Calcolare la capacità termica molare del gas a volume costante. Si assuma un comportamento ideale del gas:
A) 37,1 J mol–1 K–1
B) 65,8 J mol–1 K–1
C) 28,7 J mol–1 K–1
D) 94,5 J mol–1 K
soluzione
sappiamo anche che in una trasformazione a pressione costante Q= n Cp × ΔT. cioè
Cp = Q/nΔT
sostituendo 229=3 Cp x 2,06 da cui Cp= 229/2,06 x 3 =37,05 J/mole x grado
Per stabilire la relazione fra Cp e Cv di un gas ideale, consideriamo una trasformazione a pressione costante dallo stato A (n, pa, Ta) , allo stato B(n, pa , Tb) di un gas. Dall’espressione data sopra la quantità di calore ceduta al gas è Q=n Cp ΔT . Il gas compie un lavoro contro la pressione esterna che è costante che è L = PΔV = n RΔT ne consegue che ΔΕ = n Cv x ΔT
Dal primo principio della termodinamica ΔΕ = Q-L da cui Q= L+ ΔΕ pertanto
n CpΔT = n RΔT + n CvΔT e dividendo per ΔT si ha nCp = nR + n Cv e dividendo per n si ha Cp = R+Cv cioè si ottiene la relazione di Mayer Cp- Cv = R.
Essendo Cp -Cv =R calcoliamo Cv
Cv =37,05 – 8,3114= 28,7 J/mole x grado
18. Indicare la struttura che di un disaccaride di formula C12H22O11 sapendo che dà un test negativo con la soluzione di Benedict, non dà mutarotazione ed è idrolizzato dalla α- ma non dalla β-glucosidasi. Infine, per metilazione e successiva idrolisi chimica, dà solo il 2,3,4,6-tetra-O-metil-D-glucosio (come miscela anomerica):
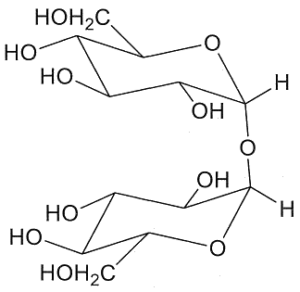
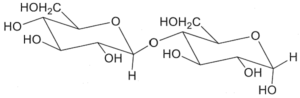
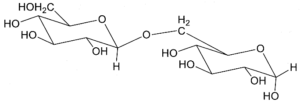
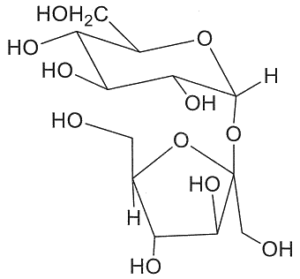
A B C D
A)
B)
C)
D)
soluzione
Un litro di reattivo di Bendict è costituito da un litro di H2O 100 g di Na2CO3 anidro, 173 g di sodio citrato e 17,3 g di CuSO4 pentaidrato ed è utilizzato per determinare la presenza di zuccheri riducenti sia mono che disaccaridi. Il citrato di sodio complessa il Cu2+ che, in presenza del carbonato di sodio, precipita come Cu(OH)2.Le sostanze organiche, come gli zuccheri riducenti, riducono Cu2+ a Cu2O, che è un precipitato di colore rosso mattone. Tra i composti proposti nel quesito, non possono essere i composti B e C perché il legame beta glucosidico presente nella molecola in questo caso avrebbe dovuto essere idrolizzato dalla beta glucosidasi ma ciò non avviene. Non può essere nemmeno il composto D perchè dopo metilazione e dopo idrolisi dà come risultato un solo composto 2,3,4,6-tetra-O-metil-D-glucosio mentre il composto D avvrebbe dovuto dare un derivato del glucosio ed uno del fruttosio.
Si deduce che il disaccaride deve essere il composto A
19. Indicare la combinazione di reagenti che, sciolti in acqua, formano una soluzione rossa:
A) AgNO3 + Na2S
B) AgNO3 + K2CrO4
C) NiCl2 + NaOH
D) CuSO4 + NH3
soluzione
il cromato di potassio viene usato come indicatore in argentometria (metodo Mohr) per l’analisi dei cloruri. I cloruri reagiscono con AgNO3 per formare un precipitato bianco di AgCl. Quando tutto il Cl- viene titolato AgNO3 forma con l’indicatore CrO4-2 il composto Ag2CrO4 che precipita al punto di equivalenza dando colorazione rossa alla soluzione.La reazione viene condotta a pH neutro o debolmente basico per pH > 10,5 l’argento precipita come idrossido e a pH < 6,5 il cromato si trasforma in bicromato Cr2O7-2.
20. È importante sia sapere che la chiralità è una proprietà delle molecole e non degli atomi, sia sapere che la condizione necessaria e sufficiente perché una molecola sia chirale è che:
A) contenga un centro stereogenico (ad es. un atomo di carbonio asimmetrico)
B) non sia sovrapponibile alla propria immagine speculare
C) possegga uno o più centri stereogenici
D) possegga un numero dispari di centri stereogenici
soluzione
L’atomo di carbonio con quattro sostituenti diversi è un atomo asimmetrico e la molecola nel suo insieme non è sovrapponibile alla sua immagine speculare cioè è chirale.
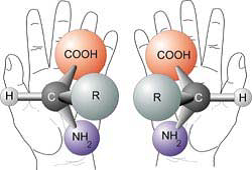
una molecola chirale non possiede un piano di simmetria e dà origine ad isomeri detti enantiomeri che hanno importanza fondamentale in biochimica.
Risposta esatta B
21 Indicare la procedura più idonea a determinare la concentrazione di H2O2 in una soluzione acquosa:
A) precipitazione con soluzione di MgCl2
B) titolazione con KMnO4
C) reazione con eccesso di zinco per H2
D) titolazione con H2SO4
soluzione
La reazione da utilizzare è una reazione di ossidoriduzione col permanganato che ossida O-2 ad O2 infatti
2 [MnO4- +5e +8H+ → Mn+2 + 4 H2O
5[O2-2 → O2 +2e
______________________________
2MnO4-+ 16H+ + 5O2-2 → 2Mn+2 +5 O2 + 8H2O
cioè
2MnO4(-) + 5H2O2 + 6H(+) ——> 2Mn(2+) + 5O2 + 8H2O
Lo ione permanganato, di colore viola, è un fortissimo OSSIDANTE nei confronti dell’ossigeno, presente nell’acqua ossigenata. Il permanganato si riduce a ione Mn(2+) che è una specie incolore ed il punto di equivalenza è raggiunto quando il permanganato non si decolora più.Il metodo analitico che utilizza il permanganato per l’analisi quantitativa è detto PERMANGANOMETRIA.
22. Una massa di acido monocloroacetico (9,45 g) viene sciolta in acqua (50,43 g) a 25 °C. Sapendo che la tensione di vapore τ della soluzione risultante è pari a 22,896 mmHg e che per l’acqua si ha τ (H2O 25 °C) = 23,800 mmHg, calcolare il grado di dissociazione dell’acido:
A) 9,62 ·10–1
B) 8,94 ·10–1
C) 4,83 ·10–1
D) 1,04 ·10–1
soluzione
l’aggiunta di un soluto ad un solvente ne abbassa la tensione di vapore e tale diminuzione è proporzionale al numero di particelle che si hanno in soluzione.
l’acido monocloroacetico si dissocia in H+ e ClCH2COO- con un grado di dissociazione α
ClCH2COOH <=> H+ + ClCH2COO-
1-α α α
il numero totale di moli è 1-α +α +α = 1+α (α = grado di dissociazione)
pertanto la diminuzione della tensione di vapore è: P° – P /P° = Xsoluto x (1+α) da cui
P° – P = P° x Xsoluto x (1+α) dove
P° = tensione vapore solvente
P = tensione vapore soluzione
Xsoluto = frazione molare del soluto = moli soluto/moli soluto+ moli solvente
passando ai dati numerici
23,8 -22,896 =23,8 x [( 9,45/94,5 ) / (9,45/94,5) +50,43/18)] x (1 + α )
0,904 = 23,8 x 0,0344 (1+ α ) 0,904= 0,819+ 0,819 α α= 0,104
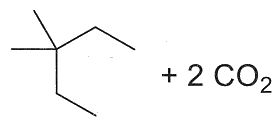
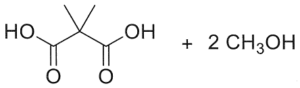
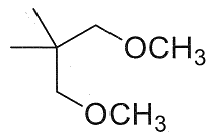
23. Indicare il prodotto della reazione:
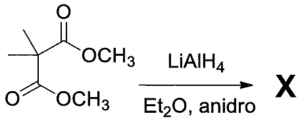
 1
1
 2
2
 3
3
 4
4
soluzione
per ridurre aldeidi e chetoni si utilizzano i composti NaBH4 ed LiAlH4 .
NaBH4 è un riducente piuttosto blando ed è usato in solvente alcolico acquoso. Riduce solo aldeidi e chetoni, mentre non riduce gli acidi carbossilici e i loro derivati né i doppi legami degli alcheni. Permette quindi di ridurre in modo selettivo il gruppo carbonilico di aldeidi e chetoni in molecole in cui vi sono anche altri gruppi funzionali.
LiAlH4 è invece un riducente più forte di NaBH4 ed è molto sensibile all’acqua perciò viene adoperato in etere. Oltre al carbonile di aldeidi e chetoni riduce molto bene gli acidi carbossilici e i loro derivati, esteri, ammidi, nitrili, ecc. ma anch’esso non è attivo nei confronti degli alcheni. LiAlH4 si lega al Carbonio del C=O che si trasforma dopo idrolisi basica in alcool e riduce CH3O- dell’estere formando anche CH3OH
Nella reazione data sopra, il reagente è un estere che forma OH al C=O e CH3OH .
In relazione a quanto sopra la risposta corretta è 3
24. E’ data la reazione 2 A + B → C + D
catalizzata da E come indicato dal seguente meccanismo:
(1° stadio) A + E →AE (veloce)
(2° stadio) AE +A →A2 + E (lento)
(3° stadio) A2 + B→ C + D (veloce)
Indicare la legge di velocità che meglio giustifica il meccanismo:
A) v = k [A] [B]
B) v = k [A] [E]
C) v = k [A]2 [E]
D) v = k [A]2 [B]
soluzione
quì abbiamo un esempio di reazione catalizzata in cui la reazione veloce è quella di assorbimento di A atomico sul catalizzatore. La reazione che viene data è 2A +B → Prodotti pertanto è la formazione di A2 che regola la velocità di tutta la reazione pertanto ai fini dell’ ottenimento dei prodotti è la reazione di formazione di A2 espressa da V=k [A]² [E] è quella che regola la reazione .
La risposta corretta è C
25. Indicare la f.e.m. finale di una pila costituita da una lamina di rame immersa in una soluzione di solfato di rame (1 L; 3,00 ·10–1 M) e da una lamina di cobalto immersa in una soluzione di cloruro di cobalto(II) (2 L; 4,00 ·10–1 M), che viene fatta funzionare fino a quando [Cu2+] = 1,00 ·10–3 M (il tutto a 25 °C).
E°(Cu2+/Cu) = + 0,337 V; E°(Co2+/Co) = – 0,28 V.
A) 6,16 ·10–1 V
B) 5,36 ·10–1 V
C) 2,51 ·10–1 V
D) 3,25 ·10–1 V
soluzione
la f.e.m. di una pila a concentrazione è definita dalla differenza tra il potenziale del catodo ed il potenziale dell’anodo.
ricordiamo l’equazione di nernst
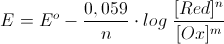
per l’elettrodo di rame
E= E° + 0,03 log[Cu+2] = 0,337 + 0,03 log 0,001=0,247
per quello di cobalto
E=E° + 0,03 + log [Co+2] = 0,28 +0,03 log 0,4=- 0,291
F.em. = Ecu – Eco
F.e.m. = 0,247 – (-0,291) = 0,538 V
26. Spesso i farmaci vengono eliminati dal corpo tramite un processo che segue una cinetica del primo ordine. L’eliminazione del Diazepam, usato in medicina veterinaria come sedativo e pre anestetico, ha una costante di velocità del 1°ordine k = 1,9 ·10–5 s–1. Calcolare quanto farmaco rimane nel corpo di un cavallo dopo 24 ore da un’iniezione di 50 mg di Diazepam:
A) 48,3 mg
B) 24,1 mg
C) 1,32 mg
D) 9,32 mg
soluzione
per una reazione del primo ordine -d[ A]/ dt = k[A]
-d[ A]/ [A] = kdt ed integrando ∫ d[ A]/ [A] = -k∫ dt ln[A]-ln[Ainiziale] =-kt ln[A]/[Ainiziale] = -kt
ln [A] = -kt + ln [Ainiziale ] = -86400 x 1,9 x 10-5 + ln 50 = -1,641 + 3,91 = 2,27
[A]= 9,6 mg
27. Un osso di elefante preistorico rinvenuto in uno scavo presso Cutrofiano (LE) contiene il 10% del carbonio 14 di un animale vivente. Sapendo che l’emivita del 14C è di 5700 anni, calcolare l’età del reperto:
A) 17500 anni
B) 18940 anni
C) 12200 anni
D) 21700 anni
soluzione
In natura esistono tre diversi tipi di atomi di Carbonio ¹²C 13C e 14C dei quali il 14C è radioattivo ed emette radiazioni β che non sono altro che elettroni. Il Carbonio 14 decade secondo la reazione 14C → 14N + °e (particelle β). Negli strati alti della Troposfera e nella Stratosfera, il 14C si forma per collisione dell’azoto con i neutroni termici che sono componenti secondari dei raggi cosmici 14N + ¹n→ 14C ma si formano anche numerosi atomi di ¹²C. Sulla terra,tutti gli organismi viventi scambiano continuamente carbonio con l’atmosfera attraverso la respirazione o la fotosintesi oppure assorbono Carbonio nutrendosi di altri esseri viventi o di sostanze organiche in generale. Sino a che un organismo è vivo, il rapporto tra la concentrazione di 14C e quella degli altri due isotopi di carbonio si mantiene costante e uguale a quella che si riscontra nell’atmosfera. Quando l’organismo muore il 14C in esso contenuto comincia a decadere e si dimezza ogni 5700 anni per cui la misura della radiazione β ci permette di risalire all’età del reperto che però non deve essere superiore a 60000 anni. Per misurare l’età di oggetti risalenti a periodi anteriori a 60000 anni si utilizza invece la misyra del 40K la cui emivita è superiore al miliardo di anni. Pertanto, se si misura la quantità di 14C che si trova nei reperti, se ne può calcolare l’età applicando la formula:
A=A0 e-kt dove k = ln2/emivita in questo caso l’emivita è 5700 anni per cui k = ln2/5700
k= 0,001216
se A0 è il contenuto di 14C negli esseri viventi, allora nel caso in esme A è 1/100 di A0
A= 0,1 A0 per cui e-0,0001216 t =0,0001216 t = ln 0,1
da cui si ottiene t = ln 0,1 /-0,0001216 cioè t=- 2,303 /-0,0001216 =18939 anni
28. Il recettore di un fattore di crescita viene prodotto nella cellula con una costante di velocità di 24,00 pM per 12,00 minuti. Assumendo che la concentrazione iniziale del recettore sia 20,00 pM e che la cellula diventi sensibile ai fattori di crescita se la concentrazione del recettore è almeno 1,00 ·10–1 nM,
si calcoli il tempo necessario per raggiungere questo livello:
A) 2400 s
B) 1200 s
C) 3200 s
D) 4000 s
soluzione
se in 1 secondo si producono 24 picomoli di recettore, per produrre 0,1 nanomoli
(100 picomoli) occorreranno X secondi
1:24 =100:X X= 2400 secondi
risposta corretta A
29. La reazione del metano con cloro in presenza di luce porta all’ottenimento di clorometani, il più semplice dei quali è monoclorometano:
CH4 (g) + Cl2 (g) + hν → CH3Cl (g) + HCl (g) Calcolare il ΔH di reazione , sapendo che:
ΔHrottura C-H = +414 kJ mol–1
ΔHrottura Cl-Cl = +243 kJ mol–1
ΔHformazione C-Cl = -339 kJ mol–1
ΔHformazione H-Cl = -431 kJ mol–1
A) +243 kJ
B) -234 kJ
C) +113 kJ
D) -113 kJ
soluzione
il ΔH di rottura di un legame è uguale al ΔH di formazione ma col segno cambiato. Inoltre, sapendo che il ΔH di reazione è dato dalla sommatoria delle energie di formazione dei prodotti meno la sommatoria delle energie di formazione dei reagenti perciò
4x 414 + 243 → – 3×414 -339 -341
1899 → – 2012
ΔH di reazione = -2012- 1899= -113
30. Il cloruro di un metallo alcalino, sottoposto ai raggi X di lunghezza d’onda λ = 1,20 ·10–10 m,presenta una riflessione del primo ordine, sotto un angolo di incidenza di 9° 59′. Calcolare la distanza tra due piani reticolari del cloruro:
A) 1,26 ·10–7 m
B) 2,45 ·10–4 m
C) 3,00 ·10–7 m
D) 3,46 ·10–10 m
soluzione
Nello lo stato cristallino è sempre presente una certa simmetria nel senso che sono presenti centri, piani ed assi di simmetria con cui e su cui si possono eseguire operazioni di rotazione riflessione ecc. Dallo spettro di diffrazione dei raggi X di un cristallo possiamo risalire al gruppo di simmetria cui la molecola appartiene ed alla distribuzione degli atomi o ioni nella cella elementare del cristallo. La determinazione della struttura cristallina si basa sulla misura delle intensità delle riflessioni date da ciascun piano che costituisce il cristallo. L’interazione tra gli elettroni di un atomo e la radiazione X, produce una radiazione diffusa (dagli atomi) che dipende, sia dal numero di elettroni presenti che dall’ angolo di incidenza. Infatti se le singole onde diffuse dagli elettroni di un atomo sono in fase si rafforzano se l’angolo di diffusione è piccolo, mentre quando l’ angolo è grande sono sfasate e si rafforzano molto meno. Quando un fascio di raggi X, (fascio primario), colpisce la superficie del cristallo, gli atomi del primo strato superficiale, diffondono per diffrazione le radiazioni del fascio incidente in tutte le direzioni. Queste radiazioni radiazioni secondarie, interagiscono con le particelle del cristallo degli strati successivi e, per effetto dell’ interferenza, si hanno, forniscono radiazioni diffuse con intensità diversa. L’intensità è massima per le radiazioni che viaggiano in fase nella stessa direzione (interferenza costruttiva) mentre quando le radiazioni viaggiano nella stessa direzione ma sfasate, si annullano reciprocamente(interferenza distruttiva).
L’analisi dei cristalli con i raggi X è stata studiata da William e Lawrence Bragg i quali fecero colpire la superficie di un cristallo con un’opportuna onda elettromagnetica ed osservarono che i piani cristallini paralleli riflettevano l’onda dando origine a fenomeni di interferenza.Infatti notarono che la riflessione non avveniva per tutti gli angoli di incidenza sulla faccia del cristallo, ma solo per determinati angoli (θ1, θ2, θ3, …) i cui valori sperimentali, noto l’angolo di incidenza θ1 potevano essere dedotti dalle formule:
sen θ2 = 2 sen θ1
sen θ3 = 3 sen θ1
sen θ4 = 4 sen θ1
Questi dati si potevano giustificare solose il cristallo era costotuito da piani paralleli equidistanti, ciascuno dei quali era costituito da un insieme di particelle posizionate in modo regolare nel cristallo. Ne dedussero quindi la seguente relazione (equazione di Bragg)
nλ =2d senθ

dove
 (teta) è l’angolo che il fascio uscente forma col piano cristallino
(teta) è l’angolo che il fascio uscente forma col piano cristallino
 (lambda) è la lunghezza d’onda della radiazione
(lambda) è la lunghezza d’onda della radiazione
d è la distanza tra due piani adiacenti
 è un intero positivo.
è un intero positivo.
dai dati del quesito possiamo quindi scrivere 1,20 ·10–10 = 2 d sen 9,59
da cui 1,2 x 10 -10 = 2 d 1,73 da cui d = 1,2 x 10 -10 / 2 x 0,1735
d= 1,2 x 10 -10 / 0,347 = 3,46 x 10-10 m
31. Indicare la reazione che avviene con diminuzione di entropia:
A) N2 (g) + O2 (g) → 2 NO (g)
B) N2O4 (g) →2 NO2 (g)
C) 2 CO (g) →C (s) + CO2 (g)
D) 2 HCl (aq) + Ag2CO3 (s)→2 AgCl (s) + CO2 (g)
+ H2O (l)
soluzione
la figura mostra l’andamento del’ entropia nei passaggi di stato:
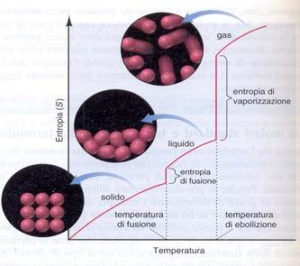
l’entropia è espressione del disordine di un sistema e quindi man mano che si passa da gas a solido o da solido a liquido l’entropia diminuisce in quanto diminuisce il disordine o meglio aumenta l’ordine del sistema.
consideriamo la reazione
A) N2 (g) + O2 (g) → 2 NO (g)
in questa reazione tutti i composti sono allo stato gassoso per cui l’entropia non diminuisce così come nella reazione
B) N2O4 (g) → 2 NO2 (g)
nella reazione
D) 2 HCl (aq) + Ag2CO3 (s) → 2 AgCl (s) + CO2 (g) + H2O (l)
non si può avere diminuzione di entropia non essendo presenti trasformazioni da gas a solido o da solido a liquido ma si ha solido solido, liquido liquido e liquido gas.
invece, nella reazione
C) 2 CO (g) → C (s) + CO2 (g)
vediamo che uno degli atomi di carbonio del CO passa dallo stato gassoso a quello solido per cui in questo caso l’entropia diminuisce.
la risposta corretta è C
32. Indicare il numero di isomeri dell’acido tartarico (2,3-diidrossibutandioico):
A) 2
B) 3
C) 4
D) 5
soluzione
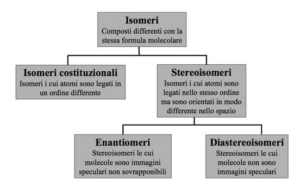
Gli stereoisomeri possiedono formula molecolare identica,ma diversa posizione spaziale degli atomi. Enantiomeri sono stereoisomeri che sono speculari e non sovrapponibili tra loro, cioè possiedono un atomo chirale (un atomo tetraedrico che ha legami con 4 atomi o gruppi diversi).
L’acido tartarico ( la molecola in alto in figura) ha 3 isomeri di cui due sono enantiomeri cioè immagini speculari (prima figura) ed un isomero che invece presenta un piano di simmetria (seconda figura)
risposta corretta B
33. Indicare i coefficienti della seguente reazione di ossidoriduzione
As2S3 + ClO3– + H2O →H3AsO4 + S + Cl–
che qui sono riportati in ordine casuale:
A) 5, 3, 5, 9, 3, 4
B) 5, 6, 5, 9, 3, 9
C) 3, 4, 5, 6, 3, 9
D) 2, 3, 5, 4, 1, 9
soluzione
3 [2AS+3 + 8H2O → 2 AsO4-3 +4 e + 16H+ +
3[3S-2 → 3S + 6 e
5[ClO3- 6H+ + 6e → Cl- + 3H2O
________________________________________
6 As+3 + 9 S-2 + 5ClO4- +30 H+ + 24 H2O → 6 AsO4-3 + 9 S + 5 Cl- + 15 H2O + 48H+
6 As+3 + 9 S-2 + 5ClO4- + 9 H2O→ 6AsO4-3 + 9 S + 5 Cl- + 18H+
la reazione bilanciata è
3 As2S3 +5 HClO4 + 9H2O→ 6H3AsO4 + 9S +5 HCl
i coefficienti sono
3 5 9 6 9 5
la risposta corretta è B
34. Indicare l’affermazione ERRATA a proposito di Numeri di Ossidazione (N.O.) degli elementi nella tavola periodica (con numerazione dei gruppi tradizionale, non IUPAC).
A) i metalli dei gruppi I, II e III formano ioni positivi con carica pari al numero del gruppo, a parte il III per il quale bisogna anche considerare il N.O. +1
B) per gli elementi dei gruppi IV e VII si deve considerare una varietà di N.O. da un minimo a un massimo che differiscono di 8 unità
C) nel tallio il N.O. +1, nel quale somiglia ai metalli alcalini, diventa più stabile del +3
D) i non metalli dei gruppi IV e VII presentano quasi tutti una varietà di stati di ossidazione con quello minimo uguale a +(8 – G), dove G è il numero del gruppo della tavola periodica
soluzione
le affermazioni A,B,C sono corrette mentre non è vera l’affermazione D
35. Indicare l’affermazione ERRATA.
A) il valore dell’energia libera di formazione di un composto è l’indice della sua stabilità termodinamica, intesa non in senso assoluto ma in relazione alla sua possibile decomposizione negli elementi da cui è formato
B) il valore dell’ energia libera di formazione di un composto è l’indice della sua stabilità, intesa in senso assoluto, in quanto se esso ha un ΔGform < 0 non solo è impedita la sua decomposizione negli elementi ma anche in qualsiasi altro composto
C) se l’energia libera di formazione di un composto è negativa (ΔGform < 0), il processo inverso (la sua decomposizione negli elementi costituenti) è impedito
D) per definire un composto termodinamicamente stabile in senso assoluto, deve avere ΔG > 0 non solo per la sua decomposizione negli elementi costituenti ma anche in qualsiasi altra sostanza
soluzione
quando il ΔG < 0 la formazione è favorita non impedita come correttamente indicato nella risposta C
La risposta errata è B
36. Indicare quanti doppi legami C=C sonopresenti nell’acido linolenico di formula C17H29COOH:
A) 2
B) 3
C) 4
D) 5
soluzione
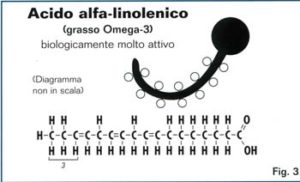
L‘acido α-linolenico (ALA) è un acido grasso n-3 insaturo della serie ω3. E’ liquido ed incolore a temperatura ambiente. Nella letteratura è anche chiamato 18:3 ω3.
L’acido alfa-linolenico ha una catena di 18 atomi di carbonio e tre doppi legami in CIS il primo dei oppi legami si trova sul terzo atomo di C a partire dalla fine del gruppo metilenicodella catena carboniosa.
L’acido α-linolenico possiede un isomero: l’acido γ -Linolenico o GLA, acido grasso della serie bomega 6 che presenta tre insaturazioni in corrispondenza dei carboni 6 e 9, 12 (18:3 ω6).
Nell’organismo è trasformato in EPA e DHA e deve essere assunto con gli alimenti perchè l’organismo non è in grado di sintetizzarlo.
37. Porre i seguenti carbocationi in ordine crescente di stabilità.
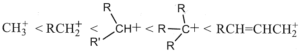
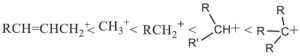
A B
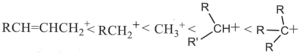
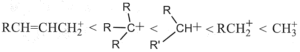
C D
soluzione
la stabilità di un carbocatione si può descrivere utilizzando gli orbitali LUMO .Gli orbitali LUMO sono uno dei due tipi di Orbitali di Frontiera cioè HOMO (highest occupied molecular orbital, orbitale molecolarea più alta energia occupato) e LUMO (lowest unoccupied molecular orbital, orbitale molecolare a più bassa energia non occupato). Un legame chimico si stabilisce quando un orbitale HOMO di un atomo interagisce con l’orbitale LUMO di un’altro originando una nuova configurazione stabilizzata. Il tipo e la differenza di energia degli orbitali HOMO/LUMO ci fornisce informazioni sulla stabilità e reattività della molecola o del gruppo atomico.
Nel caso del Carbocatione più semplice CH3+ si ha un orbitale 2Pz in cui insiste la carica positiva
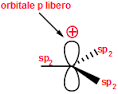
quando al posto di un atomo di H vi è un gruppo R- ( ad esempio CH3-) per formare R.CH2+, per interazione dell’ orbitale LUMO del C con l’0rbitale SP3 del gruppo R- la concentrazione della carica positiva che si trovava sull’atomo di C diminuisce e ciò aumenta la stabilità del carbocatione R-CH2+.
Aumentand il numero di gruppi R- sul Carbonio che porta la carica positiva, aumenta l’interazione tra LUMO e orbitali SP3 dei gruppi aumentando uleriormente la stabilità. La figura rappresenta inizialmente il carbocatione CH3+ il primo a destra, e quindi, spostandosi verso sinistra nella figura si osserva l’interazione per il carbocatione RCH2+ e quindi per R2CH+ ed infine per R3C+

ne consegue che la stabilità maggiore si ha per R3C+ e quella più bassa per CH3+.

Per quanto riguarda il composto che presenta un doppio legame alfa-beta rispetto alla carica positiva essendo gli orbitali Pz disponibili, la carica positiva si delocalizza ancor di più e possiede pertanto la maggior stabilità.
La risposta corretta al quesito è A
38. Un liquido incolore all’analisi elementare ha fornito i seguenti valori: C: 25,41%; H: 3,18%; Cl: 37,53%. Inoltre presenta i seguenti dati spettrali: IR: 3080, 1728 cm–1; 1HNMR: 10,35 (s, 1H), 5,36 (s,2H) ppm; 13C NMR: 173,8, 41,3 ppm. Indicare la struttura del composto:
A) ClCOOCH3
B) ClCH2COOH
C) ClCH2COCH2Cl
D)
soluzione
calcoliamo la formula minima del composto :
C = 25,41/12 =2,1 H =3,18/1 =3,18 Cl = 37,5/35,5 = 1,05 O = 33,91 /16 =2,1
dividendo per 1,05 (il numero più piccolo di grammoatmi)
C= 2 H =3 Cl=1 O= 2 la formula minima è C2H3ClO2
E’ da escludere il composto C che ha 3 atomi di C
sappiamo inoltre che lo spettro IR- può essere suddiviso in 5 range di valori che interessano la chimica organica e cioè
a. da 2700-4000 cm-1 (E-H-stretching:dove E=B, C, N, O)
b. da 2000 – 2700 cm-1 (E-X-triplo legame : E=X=C, N, O)
c. da 1500 – 2000 cm-1 (E-X-doppi legami : E=X=C, N, O)
questo è il range più importante dell’intero spettro IR infatti un forte picco tra 1640 e 1850 significa che facilmente vi è un gruppo Carbonilico CO. L’ulteriore specifica posizione del picco rivela quale tipo di carbonile è presente, infatti vi è una regola generale che dice che più reattivo è il CO, più la lunghezza d’onda aumenta rispetto a 1640 cm-1, si ha infatti la sequenza
cloruri acidi,> anidridi>, esteri> aldeidi> chetoni> acidi Carbossilici > ammidi
nel caso specifico del quesito dovremmo essere in presenza di un acido carbossilico infatti
| acido carbossilico |
picco a 1700-1725 cm-¹ |
|
ed un largo picco ulteriore tra 2500 – 3500 cm-1 |
| anidride |
~ 1760 ~1810 |
|
|
| estere |
1730-1750 |
|
picco medio o forte tra 1000 e 1300 cm-1 |
| aldeide |
1720-1740 |
|
picco medio o forte a 2750 e 2850 cm-1 |
| chetone |
1705-1725 |
|
|
| |
|
|
|
non può infatti essere nè un ‘anidride che non ha picchi ulteriori nè un estere perchè il picco ulteriore è tra 1000-e 1300 cm-1 e nemmeno un’aldeide per lo stesso motivo e nemmeno un chetone che non ha picchi ulteriori.
i valori di NMR indicano idrogeno legato ad un ossigeno e due idrogeni legati ad un carbonio (5,3 e 10 ppm)
si deduce quindi che la formula della molecola è ClCH2COOH cioè l’acido monocloroacetico
risposta B
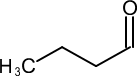
39. Indicare il reattivo necessario per effettuare la conversione indicata di seguito:
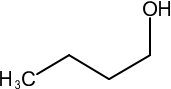 →
→ 
A) HNO3
B) K2Cr2O7/H+
C) CrO3 in piridina
D) NaBH4 oppure B2H6
soluzione
il reattivo D è da scartare perché è un riducente mentre occorre effettuare un’ossidazione.
Per effettuare l’ossidazione, occorre fare una semplice considerazione:
1 se il composto è facilmente solubile in acqua è possibile utilizzare il Cr+6 sotto forma di K2Cr2O7 in ambiente acido
2 se il composto non è facilmente solubile in acqua allora si adopera il Cr+6 sotto forma di CrO3 (anidride cromica) in piridina o in acetone
L’acido nitrico non viene generalmente usato per ossidare un alcool ad aldeide o chetone in quanto il prodotto si trasformerebbe facilmente in acido.
Nel caso in esame abbiamo una catena di atomi di C ed un ossidrile ma la solubilità in acqua non è massima per cui si preferisce effettuare l’ossidazione in solvente quale acetone (reattivo di Jones) o piridina (reattivo di Sarett) il cui vantaggio è che si possono formare aldeidi o chetoni da alcoli nella cui molecola esistono anche doppi legami che non vengono attaccati dal reattivo.
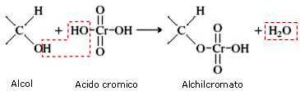
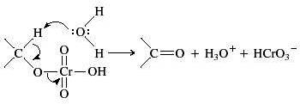
in generale nell’ossidazione di un’aldeide si osserva la produzione di acido per ulteriore ossidazione, tuttavia se l’aldeide è volatile (ad es. se ha 4 o meno atomi di Carbonio) è facilmente separabile per distillazione, ma se non è volatile occorre adoperare il reattivo di Sarett perchè la concentrazione di H2O presente nella miscela è talmente bassa da non idratare l’aldeide e quindi non forma il diolo che poi darebbe il corrispondente acido.
Risposta corretta C
40. Indicare la densità dell’alluminio se la sua cella cubica a facce centrate ha uno spigolo di 4,05 ·10–8 cm:
A) 4,10 g cm–3
B) 2,10 g cm–3
C) 3,00 g cm–3
D) 2,70 g cm–3
soluzione
se è nota la lunghezza dello spigolo di un cristallo, è possibile calcolarne la densità nel modo seguente:
se l è la lunghezza del lato della cella unitaria
se V è il volume della cella unitaria V= l³ se la cella è un cubo
densità della cella unitaria = Massa della cella / Volume della cella
massa della cella = numero di atomi nella cella x Massa di un atomo
massa di un atomo = massa atomica / Numero di Avogadro M di un atomo = M / N0
La densità della cella unitaria è = n x M / V x N0
Volume = (4,05 x 10-8)³ = 66,4 x 10-24
numero di atomi di una cella è 4 essendo il reticolo cubico a facce centrate
M= 26,98 g
densità dell’alluminio = 4 x 26,98 /66,4 x 10-24 x 6,02 x 10²³ = 107,9 /399,7x 10-1
densità Alluminio = 107,9/ 39,97 =2,699 g /cm³

I QUESITI CHE SEGUONO SONO GIA’ STATI RISOLTI E SPIEGATI NEGLI ESERCIZI DAL N.41 AL N.60 DEI QUESITI DELLA FASE REGIONALE 2013 CLASSE B A CUI RIMANDIAMO.
41. La semi-reazione che avviene in una batteria è:
PbO2 + 4 H+ + SO4-2 + 2 e → PbSO4 + 2 H2O
Pertanto, durante il funzionamento, all’elettrolita succede che:
A) aumentano densità e pH
B) aumenta la densità e diminuisce il pH
C) diminuiscono densità e pH
D) diminuisce la densità e aumenta il pH
42. Indicare la variazione di energia termica
osservata nella combustione completa di 1,00 kg di
saccarosio (C12H22O11), sapendo che per la reazione:
C12H22O11 (s) + 12 O2 (g) ® 12 CO2 (g) + 11 H2O (l)
si ha ΔH = -5,65 ·103 kJ mol–1.
A) -11,4 ·104 kJ
B) +1,65 ·104 kJ
C) -1,65 ·104 kJ
D) +11,4 ·104 kJ
43. Sapendo che l’energia di legame di H2 vale
-436 kJ mol–1, indicare il valore che si ritiene più
vicino a quello delle energie di legame di H2
+ e
He2
+:
A) -650 kJ mol–1
B) -110 kJ mol–1
C) -872 kJ mol–1
D) -220 kJ mol–1
44. Indicare i valori più vicini alla solubilità di
Ag2CrO4 a 25 °C in acqua e in soluzione acquosa di
K2CrO4 5,00 ·10–3 M:
A) 2,1 ·10–5 mol L–1 e 2,2 ·10–4 mol L–1
B) 1,0 ·10–4 mol L–1 e 1,5 ·10–2 mol L–1
C) 1,8 ·10–4 mol L–1 e 3,1 ·10–3 mol L–1
D) 1,3 ·10–4 mol L–1 e 2,1 ·10–5 mol L–1
O
CHCl
45. Curve con l’andamento mostrato in figura
spesso si riferiscono a reazioni nelle quali è presente
un catalizzatore. La parte piatta della curva è meglio
attribuita al fatto che:
A) non si forma più prodotto
B) la reazione ha raggiunto l’equilibrio
C) tutti i siti catalitici sono occupati
D) tutti i reagenti sono stati consumati
46. Avvalendosi anche delle tabelle del fascicolo,
indicare, tra i seguenti, i composti solubili e quelli
insolubili in acqua:
a) ZnCO3
b) (NH4)2S
c) FeS
d) BaSO4
A) b (solubile); a, c, d (insolubili)
B) c, d (solubili); a, b (insolubili)
C) c (solubile); a, b, d (insolubili)
D) a, b (solubili); c, d (insolubili)
47. L’acido acetico CH3COOH è solubile in acqua
in tutti i rapporti. Esso è anche solubile in benzene e
in tetracloruro di carbonio. Questo perché:
A) acqua, benzene e tetracloruro sono solventi
polari e il simile scioglie il simile
B) forma legami a ponte di idrogeno con il
benzene e gli atomi di cloro del tetracloruro
C) nei solventi riportati si ionizza rendendo il
solvente polare per polarità indotta
D) l’acido, polare in acqua, in benzene e in
tetracloruro di carbonio forma dimeri con molecole
legate con due legami a ponte di idrogeno che lo
rendono meno polare
48. Indicare, sulla base della teoria VSEPR, in
quale specie gli atomi giacciono nello stesso piano:
1. CH3
+ ; 2. CH3
–
A) solo in 1
B) solo in 2
C) sia in 1 che in 2
D) né in 1 né in2
49. La seguente reazione è endotermica:
N2O4 (g) ⇄ 2 NO2 (g)
Indicare quali cambiamenti potrebbero spostare
l’equilibrio verso destra:
A) addizione di un catalizzatore
B) abbassamento della temperatura
C) aumento del volume del reattore
D) addizione di un gas inerte per aumentare la P
50. Un campione (107 g) di una miscela di solfito
e solfato di calcio (contenente il 69,4% in massa di
CaSO3) viene trattato con HCl (aq) in eccesso. In tali
condizioni, avviene la reazione da bilanciare:
CaSO3 + HCl ® CaCl2 + H2O + SO2
Indicare la massa di SO2 prodotta se reagisce solo il
CaSO3:
A) 64,5
B) 57,1
C) 89,2
D) 39,6
51. Un minerale di ferro è formato da Fe2O3
impuro. Se nella produzione di Fe metallico puro,
ottenuto per trattamento a caldo dell’ossido con
carbone, da 812 kg di minerale si ottengono 486 kg
di Fe puro, con resa quantitativa, si può concludere
che il minerale contiene una percentuale in massa di
Fe2O3 pari a:
A) 8,56%
B) 85,6%
C) 43,0%
D) 56,0%
52. Indicare, tra le seguenti reazioni, da bilanciare,
quella che produce la maggiore quantità di O2 (g) a
partire da una stessa massa di reagente:
A) NH4NO3 ® N2 + H2O + O2
B) N2O ® N2 + O2
C) Ag2O ® Ag + O2
D) Pb(NO3)2 ® PbO + NO2 + O2
53. Una soluzione di HNO3 al 27,0% in massa ha
una densità di 1,16 g mL–1. Pertanto, le sue molarità
e molalità (M e m) sono, nell’ordine, più vicine a:
A) 4,97 ; 5,87
B) 1,56 ; 5,20
C) 2,34 ; 4,31
D) 3,20 ; 2,72
54. Indicare la specie avente geometria molecolare
piramidale a base quadrata:
A) XeF4
B) SF6
C) XeO4
D) BrF5
55. Una soluzione di quattro gas ha la seguente
composizione in volume: SO2 40,00%, N2 20,00%,
O2 30,00%, H2O 10,00%. Calcolare la composizione
percentuale in massa:
A) SO2 = 13,10%; N2 = 60,15%; O2 = 22,53%;
H2O = 4,22%
B) SO2 = 60,10%; N2 = 10,15%; O2 = 25,53%;
H2O = 4,22%
C) SO2 = 60,10%; N2 = 13,15%; O2 = 22,53%;
H2O = 4,22%
D) SO2 = 60,10%; N2 = 13,15%; O2 =12,53%;
H2O = 14,22%
56. Indicare due importanti motivi per cui le
densità dei gas differiscono da quelle dei solidi e dei
liquidi:
A) aumentano all’aumentare della T e
diminuiscono all’aumentare della P
B) aumentano in modo direttamente proporzionale
all’aumentare della P e della T (Boyle)
C) dipendono fortemente dalla P e dalla T e sono
proporzionali alla loro massa molare
D) non esiste alcuna relazione tra la densità e la
loro massa molare. Tale relazione esiste invece nei
liquidi e nei solidi
57. Indicare la relazione che si può riferire alla
stessa cella elettrolitica:
A) ΔG0 > 0; E0 = 0
B) ΔG0 > 0; E0 > 0
C) ΔG0 < 0; E0 = 0
D) ΔG0 < 0; E0 > 0
58. Indicare tra i seguenti fattori quelli(o) che
sicuramente possono (può) influenzare la velocità di
una reazione:
a) aumento (reazioni endotermiche) o diminuzione
(reazioni esotermiche) della T
b) presenza di metalli finemente suddivisi o ossidi
metallici
c) aumento della concentrazione di un reagente
d) eliminazione di un prodotto
e) variazione della T
A) a, b, c
B) e
C) a, b
D) a
59. L’urea è un importante fertilizzante prodotto
nel mondo in grandi quantità. Per produrla si parte
da miscele che contengono NH3 e CO2 in rapporto
molare 3:1 anche se la reazione è:
2 NH3 + CO2 ® CO(NH2)2 + H2O
Sapendo che, nel processo, da una mole di CO2 si
ricavano solo 47,7 g di urea, indicare, nell’ordine, la
resa teorica, reale e percentuale della reazione:
A) 30,1 g ; 24,7 g ; 82,4%
B) 50,1 g ; 42,3 g ; 79,4%
C) 30,1 g ; 32,7 g ; 40,4%
D) 60,1 g ; 47,7 g ; 79,4%
60. I reattivi di Grignard, RMgX, appartengono
alla grande classe dei reattivi organometallici.
Indicare l’affermazione ERRATA che li riguarda:
A) sono preparati per reazione di un alogenuro
alchilico o arilico con Mg metallico in un solvente
tipo etere, comunemente CH3CH2OCH2CH3
B) per reazione con un qualsiasi chetone formano
un alcool terziario
C) la loro preparazione è effettuata in assenza di
acqua perché l’acqua trasformerebbe il Grignard in
un alcool o in un fenolo e idrossido
D) per reazione con un’aldeide formano un alcool
primario o secondario a seconda dall’aldeide usata










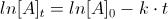
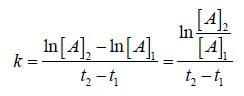





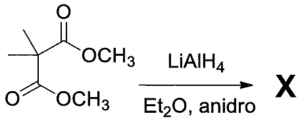
 1
1 2
2 4
4







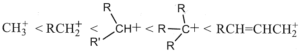
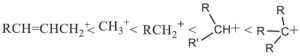
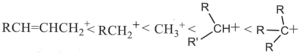
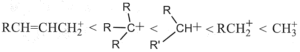



 →
→ 


