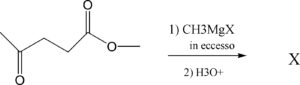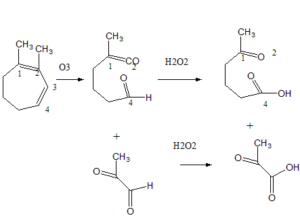GIOCHI DELLA CHIMICA 2015: FASE NAZIONALE CLASSE C
1. Una soluzione contenente NaH2PO4 e Na2HPO4ha pH = 8,0. Calcolare il pH che si ottiene aumentando di dieci volte la concentrazione dei due sali. H3PO4: Ka1 = 7,5 ·10–3; Ka2 = 6,2 ·10–8; Ka3 = 3,6 ·10–13
A) 6,0
B) 8,0
C) 7,0
D) 10
soluzione
siamo in presenza di una soluzione tampone in cui [H+] = Ka Ca/Cs
in questo caso essendo [H+] = 1 x 10-8 avremo 1 x 10-8 = 6,2 x 10-8 Ca/Cs
Ka = Ka2 perché tra i due sali in esame Na2HPO4 ed NaH2PO4 la specie acida è NaH2PO4 che contiene più idrogeno
infatti H2PO4- <=> H+ + HPO4-2 Ka2 = H+ Cs/ Ca dove Cs = HPO4-2 e Ca = H2PO4-
pertanto il rapporto Ca/Cs è 1 x 10-8 / 6,2 ·10-8 = 0,16 quindi se poniamo Ca= Ca+ 10 e Cs=Cs+10 il rapporto non cambia quindi il PH non varia e sarà sempre PH=8
2. Cosa accade aggiungendo una soluzione acquosa di FeCl3 0,10 M ad una soluzione contenente NaCl 0,01 M, NaBr 0,01 M e NaI 0,01 M?
Fe3+ + e– →Fe2+ (E° = +0,77 V)
Cl2 + 2 e– → 2 Cl– (E° = +1,36 V)
Br2 + 2 e– → 2 Br– (E° = +1,08 V)
I2 + 2 e– → 2 I– (E° = +0,54 V)
A) si forma Cl2
B) si forma Br2
C) si forma I2
D) non succede nulla
soluzione
dai dati del potenziale standard sappiamo che l’elemento con potenziale maggiore (in questo caso Fe+3) agisce da ossidante ed ovviamente si ossida l’elemento con potenziale meno positivo che in questo caso è lo iodio.Si forma quindi I2 secondo la reazione redox
2[Fe+3 +e → Fe+2
1[2I- → I2 +2e
__________________
2Fe+3 + 2I- → 2 Fe+2 + I2
3. Si intende tamponare una soluzione a pH 1. Quale sistema tampone occorre impiegare?
CH3COOH Ka = 1,8 ·10–5
HSO4– Ka = 1,2 ·10–2
HNO2 Ka = 4,5 ·10–4
HF Ka = 7,2 ·10–4
A) CH3COOH/CH3COONa
B) NaHSO4/Na2SO4
C) HF/NaF
D) HNO2/NaNO2
soluzione
in generale si utilizza il sistema tampone che possiede un Ka con un valore vicino al PH da tamponare.
In questo caso il tampone con ka più vicino a PH=1 è il tampone NaHSO4/Na2SO4 in cui l’acido HSO4- ha un Ka =1,2 x 10-² infatti : HSO4- <=> H+ + SO4-2 [H+]= 1,2 x 10-² x Ca/Cs e se desideriamo un PH=1 allora
10-¹ = 1,2 x 10-² x Ca/Cs da cui si ha un rapporto Ca/Cs = 1x 10-¹/1,2 x 10-² =8,3 cioè per avere un PH=1 occorre usare una soluzione in cui la concentrazione dell’acido NaHSO4 è 8,3 volte maggiore della concentrazione del sale Na2SO4
4. Calcolare la costante di equilibrio (in M/Pa) per
la reazione:
O2 (g) → O2 (aq)
sapendo che in una soluzione acquosa in equilibrio con l’aria alla pressione di 1,01 x 105 Pa, la concentrazione
di O2 è 14,7 mg/L. Nell’aria la percentuale di O2 è 21,0% (v/v).
A) 4,2 ·10–6
B) 5.9 ·10–9
C) 3,8 ·10–4
D) 2,2 ·10–8
soluzione
[O2] acqua = 0,0147 /32 = 4,6 x 10-4 moli/l
[O2] aria = pressione totale per frazione molare = ( 21,0 / 32 / 100/32 ) x 1,01 x 105 = 0,212 x 105
Keq = [O2] acqua / [O2] aria Keq = 4,6 x 10-4 / 0,212 x 105 = 21,7 x 10–9 = 2,2 x 10.8
5. Calcolare quante moli di KMnO4 sono necessarie per ossidare 0,10 moli di alcol etilico,secondo la reazione (da bilanciare) : CH3CH2OH + MnO4– + H+ ® Mn2+ + CO2 + H2O
A) 5,7
B) 0,24
C) 0,98
D) 3,7
soluzione
la reazione è una reazione redox dove MnO4- è l’0ssidante
12 [MnO4- + 8 H+ +5e → Mn+2 +4H2O
5 [CH3CH2OH + 2H2O → 2 CO2 +12 e +10 H+
___________________________________________
12MnO4-+ 5 CH3CH2OH +96H+ + 10 H2O → 12 Mn+2 + 10 CO2 +48 H2O +50 H+
12MnO4-+ 5 CH3CH2OH +46H+ + → 12Mn+2 +10 CO2 + 38 H2O
pertanto per 5 moli di alcol occorre usare 3 moli di permanganato quindi per 0,1 moli di alcol sono necessari
12 :5 = X: 0,1 X= 0,24
6. NaAlH4 riduce la formaldeide a metanolo,secondo la reazione (da bilanciare)
AlH4– + HCHO + H2O → Al3+ + CH3OH + OH–
Calcolare quante moli di NaAlH4 sono necessarie per ottenere 5 moli di metanolo.
A) 1,25
B) 3,80
C) 4,51
D
soluzione
4 HCHO + AlH4– + 4H2O → 4 CH3OH + 4OH-
infatti
2[4H- → H+ +8e 1 [4H- → 4H+ +8e
8[HCHO → CH3OH +2e 4[HCHO → CH3OH +2e cioè
come si vede per ogni mole di LiH4– si ottengono 4 di CH3OH pertanto
1 mole Idruro :4 moli alcol = 5 😡 X = 5/4 = 1,25
7. Un composto di formula MAx ha una solubilità di 1,0 ·10–5 M. Sapendo che la sua costante di solubilità KPS è 2,7 ·10–19, determinare, per tentativi,la formula del composto.
A) MA
B) MA2
C) MA3
D) MA4
soluzione
supponiamo che il composto abbia la formula MA se KPS= 2,7 x 10-19 [M+][A] = KPS da cui
S² =2,7 x 10-19 quindi S= 5,19 x 10-10 p Moli/l pertanto la formula non può essere MA
supponiamo che il composto abbia la formula MA2 se KPS= 2,7 x 10-19 [M+][A]² = KPS
pertanto S x (2S)² = 2,7 x 10-19 cioè 4S³ =2,7 x 10-19 S³= 2,7 x 10-19 /4 = 67,5 x 10-21 S= 4,07 x 10-7 moli/l
quindi la formula non può essere MA2
supponiamo che il composto abbia la formula MA3 in questo caso si ha Sx (3S)³ = 27 x 10-19 27 S4 = 2,7 x 10-19
S4 = 2,7 x 10-19 /27 da cui S4 = 1 x 10-20 da cui si ottiene S= 1 x 10-5 moli/l
La formula del composto è quindi MX3
8. Sulla base dei potenziali elettrodici standard, trattando il cromo metallico con un eccesso di HCl 1 M cosa si può prevedere che accada?
Cr3+ +3 e– →Cr (E° = -0,74 V)
Cr2O7–2 +14 H+ + 6 e– → 2 Cr3+ + 7 H2O (E° =1,33V)
H+ + e– → ½ H 2 (E° = 0 V)
A) si forma Cr3+ e Cr2O7–2
B) si forma solo Cr3+
C) si forma solo Cr2O7-2
D) non succede nulla
soluzione
sappiamo che l’elemento che possiede il potenziale più alto agisce da ossidante nei confronti degli elementi con potenziale più basso. Ciò detto Cr2O7-2 potrebbe ossidare l’idrogeno che ha potenziale 0 ma H+ è già ossidato . L’idrogeno H+ aggiunto ha un potenziale maggiore rispetto a Cr metallico che ovviamente si ossida. Si evince quindi che si forma solo Cr+3
9. Un acido debole HX in soluzione acquosa reagisce con un catione M+ formando un composto poco solubile MX(s) secondo la reazione
HX + M+ → MX(s) + H+
la cui costante di equilibrio vale 1,0 ·104. Sapendo che il composto MX(s) ha una costante di solubilità KPS = 1,0 ·10–12, calcolare la costante di ionizzazione Ka dell’acido HX.
A) 1,0 ·10–8
B) 3,4 ·10–9
C) 2,9 ·10–7
D) 7,0 ·10–6
soluzione
Ka2 = [H+][X-]/ [HX] Ka1 = [H+]/[M+][ HX] se moltiplichiamo i due membri dell’espressione Ka1 per [X-] si ha
[X-] Ka1 = [H+][X] /[M+] [HX] ma [H+][X]/[HX] = Ka2 quindi [X-] Ka1 = Ka2 /[M+]
ma [M+] = Kps / [X] quindi sostituendo [X-] Ka1 = Ka2 [X] / Kps perciò Ka1 =Ka2/Kps da cui
Ka2 = Ka1 x KPs Ka2 = 1,0 x 104 x 1,0 x 10-12 Ka= 1,0 x 10-8
10. Indicare quale ione può essere ossidato in una soluzione 1 M di FeCl3
Fe3+ + e– →Fe2+ (E° = +0,77 V)
Ag+ + e– → Ag(s) (E° = +0,80 V)
Zn2+ + 2 e– →Zn(s) (E° = -0,76 V)
Cd2+ + 2 e– → Cd(s) (E° = -0,40 V)
Sn4+ + 2 e– →Sn2+ (E° = +0,15 V)
A) Ag+
B) Zn+2
C) Cd+2
D) Sn+2
soluzione
dai dati di E° di riduzione vediamo che lo ione il primo ione che può essere ossidato è lo stagno Sn+2 che ha un valore di E° = +0,15 V
11. Aggiungendo una soluzione contenente ioni Ag+ 0,05 M, Pb2+ 0,05 M e Ca2+ 0,05 M ad una soluzione 0,10M di Na2SO4 , stabilire l’ordine di precipitazione dei cationi. Le costanti di solubilità sono:
KPS Ag2SO4 = 1,7 ·10–5
KPS PbSO4 = 1,8 ·10–8
KPS CaSO4 · 2 H2O = 2,4 ·10–5
A) Ag+, Pb2+, Ca2+
B) Ca2+, Pb2+, Ag+
C) Pb2+, Ag+, Ca2+
D) Pb2+, Ca2+, Ag+
soluzione
lo ione che precipita per primo è lo ione che raggiunge prima il valore del KPS cioè lo ione che ha la concentrazione necessaria più piccola per raggiungere il KPs
[Ag+]² = Kps / [SO4-2] cioè [Ag+] = √1,7 ·10–5 /0,1 = 1,3 x 10-² moli/l
[Pb+2] = KPS/[SO4-2] [Pb+2] = 1,8 ·10–8 /0,1 = 1,8 x 10-7
[Ca+2]= KPS/[SO4-2] [Ca+2]= 2,4 ·10–5/ 0,1 = 2,4 x 10-4
quindi precipita prima PbSO4 poi CaSO4 ed infine Ag2SO4
12. Una bevanda analcolica contenente glucosio, fruttosio e saccarosio è analizzata mediante HPLC, con colonna di silice derivatizzata con gruppi amminici e fase mobile acetonitrile/acqua (80:20v/v). Indicare il tipo di rivelatore da utilizzare.
A) UV-VIS
B) ad indice di rifrazione
C) fluorimetrico
D) conduttimetrico
soluzione
rivelatori uv-visibile
I più semplici fotometri rivelatori per HPLC usano sorgenti a deuterio o a tungsteno e sono dotati di una serie di filtri, ma la maggior parte degli strumenti usa una lampada a mercurio che emette le bande 250,254,313, 334 e 365 nm (nanometri). Questi rivelatori vengono usati per rivelare molecole sia organiche che inorganiche, con gruppi funzionali diversi, in grado di assorbire a quelle lunghezze d’onda.
rivelatore fluorimetrico
I rivelatori che utilizzano la fluorescenza sono più sensibili rispetto ai rivelatori uv-vis ma hanno lo svantaggio di un campo di applicabilità limitato, in quanto le specie assorbenti nell’uv-vis è notevolmente superiore rispetto a quelle fluorescenti (si usano spesso per l’analisi delle proteine) Si possono comunque usare rivelatori a fluorescenza anche per analiti non fluorescenti se vengono trattati con reagenti che forniscono prodotti fluorescenti.
rivelatori a conducibilità elettrica
Nei rivelatori elettrochimici che utilizzano la misura della conducibilità elettrica viene valutata la variazione di conducibilità della fase mobile dovuta alla presenza di specie ioniche o di sostanze di polarità differente da quella della fase mobile in uscita dalla colonna. Questo tipo di rivelatore viene generalmente usato quando si utilizzano fasi mobili acquose e si analizzano molecole a carattere ionico come ad es. gli amminoacidi ma bisogna far attenzione alla temperatura perché la conducibilità varia al variare di questa e le misure, come è noto, vengono effettuate in corrente alternata in quanto con la corrente continua gli elettrodi si polarizzano.
rivelatore ad indice di rifrazione (rifrattometro)
In questo tipo di rivelatore viene misurato l’indice di rifrazione della fase mobile in uscita dalla colonna e se ne valuta la variazione al passaggio del soluto.Le microcelle dove viene effettuata la misura sono sensibili alle bollicine di aria quindi la fase mobile deve essere opportunamente degasificata. Ovviamente la fase mobile deve avere un basso indice di rifrazione. Viene utilizzato soprattutto per l’analisi degli zuccheri ma non ha una grande sensibilità infatti il limite di sensibilità è dell’ordine di circa 10–7 g/mL.
Da quanto esposto la risposta corretta è la B
13. Due recipienti (A e B) termostatati a 298,15K sono a contatto tramite una parete rigida semipermeabile, attraverso cui passano le sole molecole di solvente. Dire cosa accade se in A viene posto un dm3 di una soluzione 0,01 M di glucosio mentre in B viene posto un dm3 di una soluzione 0,01 M di cloruro di sodio:
A) l’acqua passa da A a B
B) l’acqua passa da B ad A
C) non si osserva passaggio netto di acqua
D) parte dell’acqua contenuta in A evapora
soluzione
In questo caso osserviamo la proprietà colligativa delle soluzioni che è la Pressione Osmotica regolata dall’equazione di Vant’Hoff che per un non elettrolita come il glucosio è
π V = n RT
mentre per gli elettroliti occorre moltiplicare il secondo membro per il numero di ioni i che si formano ad es. NaCl i=2 (due ioni Na+ e Cl-)
π V = i n RT
pertanto per il glucosio e per NaCl V= 1 litro e T=298,15 ed n=0,01 moli /l
quindi per il Glucosio π = 0,01 x 0,0821 x 298,15 /1 = 0,2448 atm
Per NaCl π = 2 x 0,01 x 0,0821 x 298,15 /1 = 0,4896 atm
da questi dati si vede che il solvente passerà dalla soluzione contenente glucosio a quello contenente NaCl per stabilire l’equilibrio.
14. Mediante un processo adiabatico in cui non avvengono reazioni chimiche, un sistema chiuso viene portato da uno stato iniziale 1 ad uno stato finale 2. Il lavoro scambiato:
A) è necessariamente nullo
B) dipende dell’effettivo percorso seguito
C) non dipende dell’effettivo percorso seguito
D) nessuna delle risposte precedenti è corretta
soluzione
essendo Q = 0, per il 1° principio L = – ΔU = – n Cv (Tfi – Tin) = n Cv (Tin – Tfi)
Si possono verificare due casi:
- ΔU > 0 : il sistema compie lavoro sull’esterno che viene effettuato a spese dell’energia interna che risulta minore di zero
- ΔU < 0 : viene compiuto lavoro sul sistema e viene immagazzinato come energia interna che risulta maggiore di zero
Quando il lavoro è fatto dal sistema si ha una diminuzione di temperatura mentre se è fatto sul sistema si ha un aumento della temperatura.
il Lavoro adiabatico quindi è ΔU = – nCvdT e ricordando che Cp-Cv =R ΔU = – n( R-Cv ) dT
e quindi non dipende dal percorso seguito.
La risposta corretta è C
15. A e B sono due soluzioni 10–3 M rispettivamente di acetato di etile e acido acetico in un solvente
apolare aprotico. Si può affermare che:
A) A e B hanno circa la stessa temperatura di congelamento
B) B ha una temperatura di congelamento minore di quella di A
C) A ha una temperatura di congelamento minore di quella di B
D) nessuna delle risposte precedenti è corretta
soluzione
un solvente aprotico è un solvente la cui struttura non presenta atomi di idrogeno dissociabili. I solventi aprotici apolari, non hanno momento dipolare apprezzabile ed in essi si sciolgono i composti apolari. Acetato di etile ed acido acetico si sciolgono poco nel solvente apolare aprotico tanto che la concentrazione fornitaci è 0,001 M. In ogni caso, l’aggiunta di un soluto in un solvente, causa la diminuzione del punto di congelamento della soluzione rispetto al solvente puro e l’entità della diminuzione dipende dalla concentrazione delle particelle del soluto che vengono aggiunte e dal loro numero.La diminuzione della temperatura è calcolata da Δt = i Kcr M dove i è il numero di particelle del soluto ed M è la molalità (moli/Kg) mentre Kcr è la costante crioscopica del solvente. L’acido acetico, nei solventi apolari forma dei dimeri e questo si riflette nell’aumento della temperatura di ebollizione e nella diminuzione ulteriore del punto di congelamento. Non solo, ma anche se in piccole quantità l’acido acetico si dissocia debolmente formando quindi 2 specie H+ e CH3COO- .Si deduce, pertanto, che a parità di concentrazione ed essendo Kcr del solvente uguale sia per l’acido acetico che per l’acetato di etile, il valore di Δt è maggiore per l’acido acetico che per l’acetato di etile. Da quanto detto si evince che la risposta corretta è C
16. Se in una reazione si ha: ΔG° = +110 kJ mol–1 a 25 °C eΔG° = +140 kJ mol–1 a 35 °C, si può affermare che:
A) il valore della costante di equilibrio della reazione è maggiore di 1
B) la reazione è endotermica
C) la reazione è esotermica
D) nessuna delle risposte precedenti è corretta
soluzione
una reazione è esotermica se comporta una diminuzione di entalpia ( ΔH negativo ) mentre è endotermica se comporta un aumento di entalpia.
in una reazione R → P dove R= Reagenti e P= Prodotti sappiamo che ΔH=∑Hreagenti – ∑Hprodotti
se si produce calore allora significa che ∑Hreagenti è più grande di ∑Hprodotti
G=H-TS dG = dH –TdS –SdT
Se T=Costante dT=0
dG=dH-TdS
ΔG = ΔH – TΔS e nello stato standard
ΔG° = ΔH° – TΔS° quindi ΔG° nelle reazioni esotermiche è positivo .
Infatti in questo caso ΔG° rimane positivo all’aumentare della temperatura il che significa che la reazione è esotermica.
17. La reazione elementare: A → prodotti segue una cinetica di primo ordine. Cosa è possibile presumere sul suo meccanismo di reazione?
A) la reazione decorre a causa di una instabilità intrinseca di A
B) la reazione decorre a causa degli urti tra le molecole di A e quelle dei prodotti
C) la reazione decorre a causa degli urti tra le molecole di A
D) nessuna delle risposte precedenti è corretta
soluzione
per una reazione A →prodotti che segue una cinetica del primo ordine v = K[A] o meglio v =- ΔA/Δt dove
ΔA = concentrazione finale – concentrazione iniziale. (Il segno meno si riferisce alla diminuzione di A nel tempo). La velocità istantanea della reazione per Δt tendente a zero è :
v = – dA/dt quindi K[A] = – dA/dt K[A] dt = – d[A] Kdt = – d[A]/[A] ed integrando si ha:
ln [A]/[Ao] = – k ( t – to) dove [Ao]= concentrazione iniziale ed [A] = concentrazione dopo un tempo t. Generalmente si pone il tempo iniziale to=0 per cui :
ln [A]/[Ao] = – kt e, per le proprietà dei logaritmi :
ln [A] – ln [Ao] = – kt
l’unità di misura di k, in una reazione del primo ordine è sec-1. In una reazione del primo ordine, pertanto, il logaritmo naturale di [A] è una funzione lineare del tempo. Riportando in grafico ln [A] in funzione di t, otteniamo una retta di pendenza pari a –k e la cui intercetta all’origine (t=0) corrisponde a ln [Ao].
La formazione dei prodotti dal composto A certamente non dipende dagli urti delle molecole di A con i prodotti, né tantomeno tra gli urti tra molecole di A perché anche urtandosi A non forma i prodotti. I prodotti si formano a causa della instabilità del composto A che per motivi diversi ( es temperatura ) si decompone formando i prodotti. un esempio è l’inversione del saccarosio in ambiente acido oppure la decomposizione dell’acetone CH3COCH3→CH3CH3 + CO oppure ancora la decomposizione del diazometano (CH3)2N2 →N2 + C2H6.
Risposta corretta è A
18. Per una reazione con legge cinetica v = k [A]x [B]y si ha che k = 4,8 dm6 mol–2 s–1. Qual è l’ordine della reazione?
A) la reazione è di ordine due
B) la reazione è di ordine tre
C) la reazione è del primo ordine
D) nessuna delle risposte precedenti è corretta
soluzione
Abbiamo già visto che l’unità di misura di k, in una reazione del primo ordine è sec-1
sappiamo inoltre che la cinetica per una reazione aA+ b B →Prodotti
in forma differenziale è : v = – d[A]/dt = K[A][B] se a = b = 1 e [A0] è diverso da [Bo]
se a = b = 1 e [Ao]= [Bo] la velocità è v = – d[A]/dt = K[A]2
K = 1/t ( 1 /[A] – 1 / [Ao])
se la reazione è 2 A → Prodotti si ha ancora v = – d[A]/dt = K[A]2 e K = 1/t ( 1 /[A] – 1 / [Ao])
se esprimiamo il tempo in secondi e la concentrazione delle sostanze in mol/L si verifica che l’unità di misura della costante K delle reazioni di secondo ordine vale :
1/s x mol/L = L/s x mol cioè litri x secondo-1 x mole-1
nelle reazioni del terzo ordine, del resto non molto comuni, del tipo 2 A + B → Prodotti
si ha v = – d[A]/dt = K[A]2[B]
se invece la reazione è del tipo
3A → Prodotti
Si ha v = -d[A]/dt = K[A]3 che integrata diventa: K = 1/2t( 1 /[A]2 – 1/[Ao]2)
da questa espressione si ha l’unità di misura di K di una reazione del terzo ordine :
L2/mol2 x s cioè litri² x moli-² x secondi-1
Poiché il quesito ci fornisce il valore di K =4,8 dm² mol-2 S-1 ne consegue che si tratta di una reazione con cinetica del terzo ordine.
19. Per una reazione del tipo A → B si è trovato che il tempo di dimezzamento aumenta linearmente all’aumentare della concentrazione iniziale di A. Da questo si può desumere che:
A) i dati non sono sufficienti per definire l’ordine
B) la reazione è di ordine zero
C) la reazione è di secondo ordine
D) la reazione è di primo ordine
soluzione
Per una reazione del primo ordine t(1/2) = ln(2)/k = 0.69/k Il tempo di dimezzamento è indipendente dalla concentrazione iniziale e rimane costante.
Per una reazione del secondo ordine t(1/2) = 1/k[A]o In questo caso il tempo di dimezzamento dipende della concentrazione iniziale e raddoppia ad ogni dimezzamento.
si deduce che se il tempo di dimezzamento dipende dalla concentrazione iniziale ed all’aumentare di questa aumenta linearmente, si deduce che la reazione è del secondo ordine.
20. Due molecole di acqua di una soluzione acquosa sono impegnate nella formazione di un legame a idrogeno. Indicando con A e B le due distanze dell’idrogeno-ponte dai due atomi di ossigeno, quale delle seguenti osservazioni è vera?
A) A e B sono uguali
B) una delle due (A o B) è uguale a zero
C) A e B sono differenti
D) i dati forniti non sono sufficienti per rispondere.
\
il legame idrogeno è una delle forze intermolecolari in cui è implicato un atomo di idrogeno. La figura mostra il legame idrogeno che si stabilisce tra le molecole di acqua : l’idrogeno, che ha una debole carica positiva, viene attratto dall’ossigeno che ha una debole carica negativa dovuta al momento di dipolo che si instaura nella molecola di acqua a causa della differenza di elettronegatività tra l’atomo di ossigeno e quello dell’idrogeno che determina una asimmetria nella nuvola elettronica del legame OH. Come si può osservare in figura, le distanze stabilite nel legame idrogeno sono superiori alle distanze tra l’idrogeno e l’ossigeno nella molecola ed è una caratteristica del legame idrogeno che mantiene le molecole più distanti tra loro rispetto ad altri tipi di legame. Infatti il legame OH nella molecola è più breve rispetto al legame H2O—H-O-H, non solo, ma essendo il legame idrogeno un legame direzionale, cioè essendo più forte tra molecole che si trovano sulla stessa linea che non tra quelle che non sono su una stessa retta, la posizione dell’idrogeno rispetto alle due molecole che unisce, non sempre è equidistante dalle due molecole ed è quindi variabile sia nella forza che nella distanza.
21. Per una certa reazione i dati sperimentali hanno mostrato che quando la temperatura aumenta, la costante di equilibrio non subisce variazioni apprezzabili. Assumendo che ΔH° e ΔS° siano indipendenti dalla temperatura, si può affermare che:
A) la reazione è endotermica
B) la reazione è esotermica
C) la reazione è atermica
D) nessuna delle risposte precedenti è corretta
soluzione
una reazione esotermica (esoergonica) produce energia generalmente sotto forma di calore. Un esempio tipico sono le la reazioni di combustione.
in questo caso dln K/dt= ΔH°/RT² dove ΔH° è l’entalpia standard della reazione e nelle reazioni esotermiche ΔH° è negativo
(ricorda che ΔH= ∑Hprodotti – ∑Hreagenti) . Un aumento della temperatura produce un aumento di K cioè si dovrebbe formare meno prodotto quindi nelle reazioni esotermiche la formazione di prodotto è favorita da una diminuzione della temperatura.
Una reazione endotermica (endoergonica) invece, assorbe calore dall’ambiente circostante e spesso ha bisogno di continuo flusso di energia per potersi realizzare. Un esempio è la solubilizzazione del cloruro di ammonio spesso commercializzato come ghiaccio istantaneo, oppure ad es l’elettrolisi che richiede energia elettrica. In una reazione endotermica il ΔH° è positivo e la formazione di prodotto è favorita da un aumento di temperatura.
Le reazioni atermiche (anergiche) invece, tra l’altro poco comuni, non producono né assorbono energia. In tal caso ΔH° =0 e la temperatura non ha alcuna influenza sul prodotto di reazione. In questo caso dln K/dt= ΔH°/RT² se il numeratore è 0 è chiaro che qualsiasi variazione di T non influenza il valore di K.
si deduce che la risposta esatta al quesito è la C
22. La decomposizione termica dell’acetaldeide segue una cinetica del secondo ordine. Nell’intervallo di temperatura 700-1000 K, l’energia di attivazione del processo è 189 kJ mol–1, mentre il fattore pre-esponenziale vale 1,1 ·10¹² dm3 mol–1 s–1.
A 790 K la costante cinetica del processo vale circa:
A) 7,5 dm3 mol–1 s–1
B) 0,035 dm3 mol–1 s–1
C) 0,35 dm3 mol–1 s–1
D) 0,75 dm3 mol–1 s–1
soluzione
sappiamo che la costante di velocità di una reazione dipende dalla temperatura secondo l’espressione di Arrhenius
K = cost·exp(-ΔE/R·T) in cui ΔE = energia di attivazione .
Nel caso specifico Cost = 1,1 x 10¹² ΔE=189 KJ/mol R= 8,314 e T=790k
pertanto Kcinetica = 1,1 x 10¹² exp(-189000/8,314 x 790) Kcinetica = 1,1 x 10¹² exp-0,318×10–¹²
Kcinetica = 1,1×0,318= 0,3498
23. Il calore non è una funzione di stato. Per cosa bisogna moltiplicarlo per renderlo tale?
A) per la temperatura
B) per il reciproco della temperatura
C) per il lavoro
D) per la pressione
soluzione
il primo principio della termodinamica è E= Q+ L quindi per avere una funzione di stato non si può moltiplicare per il lavoro, occorrerebbe sommarlo. Sappiamo però che il secondo principio della termodinamica ci dice che S=Q/T cioè la funzione di stato ottenuta moltiplicando il calore per 1/T è S cioè l’Entropia. Pertanto la risposta corretta è la B
24. La temperatura critica di una sostanza pura è:
A) la temperatura al di sotto della quale il gas non può essere liquefatto agendo unicamente sulla pressione
B) la temperatura al di sopra della quale il gas non può essere liquefatto agendo unicamente sulla pressione
C) la temperatura di equilibrio tra le tre fasi
D) nessuna delle risposte precedenti è corretta
soluzione
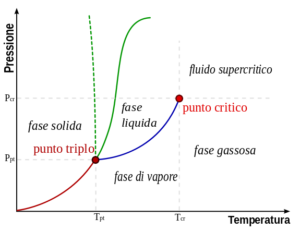
osserva il grafico: rappresenta il comportamento di una sostanza in funzione della pressione e della temperatura ed è chiamato diagramma di fase. La temperatura Ttr è detta temperatura del punto triplo (nel grafico è la temperatura che corrisponde al punto che unisce le tutte le curve, cioè il punto in cui le tre fasi vapore, liquido e solido sono in equilibrio. Se consideriamo un vapore e manteniamo costante la temperatura, per esempio in un intervallo di T che in figura è compresa tra Ttr e Tc ed aumentiamo gradualmente la pressione , ad un certo valore di pressione il vapore diventerà liquido perché le forze attrattive tra le molecole bilanciano e superano la loro energia cinetica. Il passaggio allo stato liquido lo si ottiene però solo se la temperatura è al di sotto della temperatura indicata nel grafico con Tc. Infatti alla temperatura Tc il vapore non potrà mai diventare liquido qualunque sia l’aumento di pressione come indicato nel grafico. La temperatura Tc è la TEMPERATURA CRITICA ed è caratteristica per ogni sostanza. La risposte corretta è C
25. Un sistema isolato subisce un processo reversibile.
A) sia l’entropia del sistema sia quella
dell’universo aumentano
B) l’entropia del sistema aumenta mentre quella dell’universo rimane costante
C) sia l’entropia del sistema sia quella dell’universo rimangono costanti
D) nessuna delle risposte precedenti è corretta
soluzione
Consideriamo un sistema in cui avviene un processo reversibile cioè un processo in cui uno stato differisce da quello successivo solo di un infinitesimo. Supponiamo che questo sistema passi da uno stato iniziale a uno stato finale, vicinissimo a quello iniziale, e che in questo passaggio assorba dall’esterno il calore dQrev. In un processo reversibile la temperatura Ts del sistema è uguale a Ta la temperatura dell’ambiente pertanto si ha :
dSsistema = dQrev/Ts
contemporaneamente però l’ambiente esterno, diminuisce la propria entropia della medesima quantità essendo Ts=Ta,
dSambiente = – dQrev/Ta = – dQrev/Ts e se sommiamo membro a membro dSsistema e dSambiente si ha :
dSsistema + dSambiente= dQrev/Ts – dQrev/Ta=0
che per processi finiti assume la forma
ΔSsistema + ΔSambiente= 0
Pertanto in una trasformazione reversibile l’entropia del sistema aumenta o diminuisce nella medesima misura con la quale diminuisce o aumenta l’entropia dell’ambiente esterno. In un sistema isolato costituito da sistema ed ambiente in cui il sistema è sottoposto ad un processo reversibile la variazione di entropia è pari a zero.
26. Quando si mescolano due gas che si comportano idealmente accade che:
A) ΔG < 0, ΔS < 0, ΔH = 0
B.) ΔG < 0, ΔS > 0, ΔH = 0
C) ΔG = 0, ΔS > 0, ΔH = 0
D) ΔG > 0, ΔS > 0, ΔH > 0
soluzione
la maggior parte dei gas reali si comportano come gas ideali quando si trovano in condizioni temperatura e pressione standard. Ciò permette di applicare alle miscele di gas i metodi di calcolo utilizzati per i gas ideali per ottenere le equazioni termodinamiche che descrivono quantitativamente gli effetti del mescolamento. L’energia totale di Gibbs per un sistema di due gas è data da:
G=n1G1 + n2G2 dove G è l’energia libera totale di Gibbs del sistema, n1 ed n2 sono il numero di moli del componente 1 e 2 rispettivamente mentre G1 e G2 è l’energia libera di Gibbs detta anche energia molare parziale di Gibbs. L’energia molare di un gas è calcolata da
G = G∘+RTlnP1/bar dove G° è l’energia molare standard e P la pressione del gas
in una miscela di gas l’energia molare parziale di un gas è uguale al suo potenziale chimico μ Gi = μi
Gi= μ i= μ°i + R T ln Pi/1bar dove μ°i è il potenziale standard del componente gassoso i e ne consegue che
Giniziale=n1(μ∘1+RTlnP)+n2(μ∘2+RTlnP)
Gfinale=n1(μ∘1+RTlnP1)+n2(μ∘2+RTlnP2) da cui ΔGmiscela =Gfinale−Ginizia= n1RTlnP1/P+n2RTlnP2/P
o meglio ΔGmiscela =n1RTlnx1+n2RTlnx
dove x è la frazione molare del gas 1 e 2 .
in definitiva quando la reazione avviene spontaneamente ed è irreversibile come nel caso del miscelamento di due gas allora ΔG < 0
Per quanto riguarda l’entropia di miscelamento, supponiamo che il gas 1 sia posto in un recipiente costituito da due compartimenti uguali separati da una parete:
se viene eliminata la parete, il gas si espande in un volume che è il doppio dell’iniziale e quindi l’entropia dovrà aumentare. Analogo risultato ci aspettiamo per il gas 2.
Quando in uno dei due compartimenti si trova il Gas 1 e nell’altro il gas 2, e la parete viene tolta, si osserva l’espansione di ambedue i gas. Sappiamo che ( dG/ dT)p=−S pertanto l’entropia di miscela è data da
(dGmis/ dT)p=nR(x1lnx1+x2lnx2) = –ΔSmisc cioè
ΔSmisc=−n R (x1 ln x1+x2 ln x2)
e poiché la frazione molare porta a valori negativi, ne consegue che ΔSmis è positivo
e questo conferma che il miscelamento di due gas è un processo spontaneo.
Per quanto riguarda l’Entalpia della miscela, essendo ΔG=ΔH−TΔS allora ΔHmisc =ΔGmisc +TΔSmisc
per cui si ha che
ΔHmisc =nRT(x1lnx1+x2lnx2)+T[−nR(x1lnx1+x2lnx2)]=0
da quanto esposto si vede che nel mescolare due gas si ha ΔGmisc < 0 ΔSmisc > 0 ΔHmisc =0
La risposta corretta è la B
27. Calcolare a quale pressione bisogna comprimere una mole di biossido di carbonio alla temperatura di 500 K per portarne il volume a 0,41 dm3, sapendo che il gas segue l’equazione di stato di van der Waals con a = 0,365 m6 Pa mol-2 e b = 4,29 ·10–5 m³ mol–1.
A) circa 510 kPa
B) circa 5100 kPa
C) circa 910 kPa
D) circa 9100 kPa
soluzione
sappiamo che l’equazione di Van der Waals è : (P + a n2/V2) (V – nb) = nRT dove
n = numero di moli di gas P = pressione esercitata dal gas cioè la sua Preale V = volume recipiente
R = costante universale dei gas T = temperatura assoluta ed a e b sono due costanti caratteristiche per ogni gas
pertanto
p = [nRT/(V-nb)] – n2a/V2
essendo n=1, R= 0,0821 T= 500 V= 0,41 a= 0,365 b= 4,29 x 10-5
P=[ 1 x 0,0821 x 500 / ( 0,41 – 1x 4,29 x 10-5 )] – 1x 0,365 /( 0,41)² = 97,96 atm = 9925 KPa
28. L’energia di Gibbs diminuisce all’aumentare della temperatura. Per quale delle fasi tale diminuzione è maggiore?
A) per i gas
B) per i liquidi
C) per i solidi
D) è uguale per tutte le fasi
soluzione
Solidi e Liquidi sono sostanzialmente incomprimibili ( ΔG = V ΔP)
per un gas a p=k si ha dG= – SdT ΔG(T2) – ΔG(T1) = – ΔS (T2-T1)
la diminuzione dell’energia di Gibbs con l’aumentare delle temperatura è maggior eper un gas che per liquidi e solidi in quanto la variazione di entropia per il gas è maggiore che non lei liquidi o solidi.
29. La reazione che da A e B porta al prodotto C avviene secondo il meccanismo: A + B→ I-kb —→ C
dove I è un intermedio di reazione. Si trova sperimentalmente che la velocità di produzione di C è
v = kb·K–1 [A] [B], dove K è la costante di dissociazione di I in A e B e kb è la costante cinetica
della reazione di conversione di I in C. Da questo si può desumere che la trasformazione di I in C:
A) avviene con velocità uguale a quella con cui I si trasforma in A e B
B) è estremamente più veloce rispetto a quella con cui I si trasforma in A e B
C) è estremamente più lenta rispetto a quella con cui I si trasforma in A e B
D) nessuna delle risposte precedenti è corretta
soluzione
la costante di dissociazione di I in A e B è data da K= [A][B]/[I]
ed essendo la velocità di reazione V= kb [I] sostituendo ad[I] il valore [A][B]/K si ha la velocità della reazione I→C v= (Kb /k) x [A][B] il che significa che la reazione di formazione di I ha una cinetica del secondo ordine e quella di formazione di C ha una cinetica del primo ordine. Poiché la velocità di formazione di C dipende dall’inverso di K quindi la velocità di formazione di C è bassa per cui la velocità di dissociazione di I in A e B è più alta della velocità di formazione di C. La risposta corretta è C
30. Il composto A, la cui tensione di vapore a 35,2 °C è 39,1 kPa, ed il composto B, la cui tensione divapore a 35,2 °C è 44,5 kPa, sono miscibili, allo stato liquido, in tutte le proporzioni. Una soluzione in cui la frazione molare di B è pari a 0,5 ha una tensione di vapore pari a 45,1 kPa, sempre a 35,2 °C. Da ciò è possibile desumere che:
A) A e B formano un azeotropo
B) le interazioni A-B sono di uguale entità rispetto a quelle nei liquidi puri
C) la soluzione ha comportamento ideale.
D) nessuna delle risposte precedenti è corretta
soluzione
La miscela è un azeotropo.
Una miscela azeotropica è una miscela composta da due o più liquidi che nella distillazione non variano la propria composizione. I liquidi che compongono l’azeotropo mostrano attrazioni o repulsioni tra le molecole dovuti alla formazione di legami intermolecolari e ne consegue che la miscela non si comporta come una miscela ideale e quindi non segue la legge di Raoult che è:
Pa = P°aXa per il componente A dove P°a = pressione parziale di A e Pa = pressione totale Xa= frazione molare di A=na/na + nb dove con n si indica il numero di moli.
analogamente per B si ha:
Pb = P°bXb per il componente B
Le deviazioni da questa legge possono essere positive o negative e quindi l’azeotropo è detto positivo o negativo ed i diagrammi Temperatura -Concentrazione esibiscono un massimo o un minimo

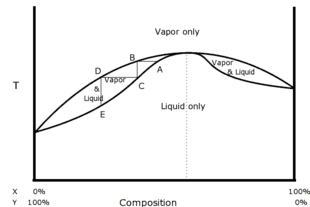
Nel caso specifico la frazione molare è 0,5 cioè 1/2 il che significa che i due liquidi sono miscelati in rapporto 1:1 e la tensione di vapore è superiore sia a 39,1 kPa del composto A e superiore alla tensione di vapore 44,5 kPa del composto B quindi questo è azeotropo con deviazione positiva in quanto la sua tensione di vapore è 45,1 kPa.
31. Il diagramma di stato P-T (pressione in funzione della temperatura) dell’acqua presenta una peculiarità rispetto a quelli della maggioranza delle altre sostanze pure.
A) non si individua il punto critico
B) la curva di coesistenza solido-liquido ha pendenza negativa
C) non esiste la regione di stabilità del liquido
D) nessuna delle risposte precedenti è corretta
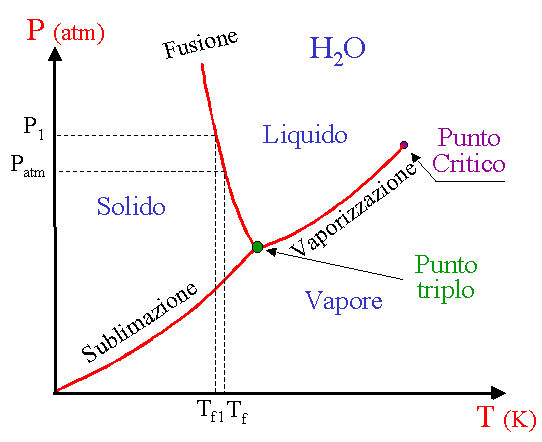
come si vede nel grafico, il punto triplo è ben definito, e la regione di stabilità del liquido è anche ben chiara, e la linea costituita dai punti di equilibrio solido liquido (nel grafico è indicata fusione) ha pendenza negativa. la risposta corretta è B
32. Nella reazione Cl2O(g) + H2O(g) → 2 HOCl(g) a 298 K la costante di equilibrio è K = 8,2 ·10–2 e ΔS° = 32,76 JK-1
Da questi dati si può desumere che:
A) la reazione è entropicamente sfavorita
B) la reazione è entalpicamente favorita
C) la reazione è esotermica
D) la reazione è endotermica
soluzione
quando si ha una reazione chimica, i legami presenti nelle molecole dei reagenti si spezzano e si creano nuovi legami che formano i prodotti di reazione. Perché i legami si spezzino è necessaria una certa energia che in genere è fornita dall’energia cinetica delle molecole, che nel collidere formano i prodotti. Se forniamo calore dall’esterno, aumentiamo l’energia cinetica delle molecole e la reazione viene quindi favorita. La prima fase di una reazione è quindi quella di aumentare l’energia dei reagenti sino ad certo valore che rende attive le molecole e che viene definita Energia di Attivazione. Ovviamente nella formazione dei nuovi legami l’energia acquisita viene rilasciata sotto forma di calore.

Nel grafico si vede che in una reazione X → Y le molecole di X devono acquisire l’energia indicata dalla freccia nera a sinistra nel grafico, e viene indicata l’energia del prodotto Y. La differenza di energia tra quella iniziale e quella finale rappresenta il calore di reazione e si definisce variazione di entalpia della reazione ΔH espressa in KiloJaules /mole .
Le reazioni chimiche sono classificate in reazioni esotermiche e reazioni endotermiche. Nelle reazioni esotermiche l’energia viene prodotta nella reazione sotto forma di calore ed infatti l’energia del prodotti Hp è quindi minore di quella dei reagenti Hr e quindi la variazione di energia cioè la variazione di entalpia ΔH è minore di zero in quanto
ΔH = Hp – Hr.
Nelle reazioni endotermiche viene invece assorbita energia sotto forma di calore che serve per rompere i legami presenti nei reagenti ed è rilasciata quando si formano i nuovi legami chimici dei prodotti. L’energia assorbita risulta maggiore di quella fornita e i prodotti di una reazione endotermica hanno un’energia superiore rispetto a quella dei reagenti ovvero Hp > Hr e quindi ΔH = Hp > Hr > 0.

In questo grafico la reazione X→ Y è una reazione endotermica in quanto il prodotto ha energia superiore a quella del reagente per cui il ΔH >0. L’energia cinetica delle molecole si è trasformata in energia potenziale con una diminuzione della temperatura del sistema ( la temperatura è un indice dell’energia cinetica delle molecole) e l’energia potenziale dei prodotti è maggiore rispetto a quella dei reagenti. Le reazioni endotermiche possono avvenire a temperatura ambiente se vi è un notevole incremento di entropia. Infatti essendo ΔH = Q ed essendo ΔH >0 nelle reazioni endotermiche sapendo inoltre che ΔS= Q/T è evidente che un ΔS>0 indica una reazione endotermica.
33. Calcolare la resa percentuale della reazione 4 Al (s) + 3 O2 (g) →2 Al2O3 (s) se mettendo a reagire 8,00 moli di Al con 3,00 moli di O2 si formano 160 g di Al2O3.
A) 39,2%
B) 19,6%
C) 52,3%
D) 78,4%
soluzione
se in teoria da 4 x 26,98g di Al si ottengono 203,9 g di Al2O3 da 8 x 26,98 g si otterranno Xg
215,84 x 203,9 / 107,9 = 407,89 g di Al2O3
in pratica invece si ottengono solo 160 g di Al2O3 perciò il rendimento della reazione (Resa) è
407,89 :160 =100 : X X= resa % = 39,22 %
34. 3,00 g di vanadio metallico reagiscono esattamente con 6,26 g di cloro molecolare secondo la seguente reazione:
V + x/2 Cl2 → VClx
Determinare la formula del cloruro VClx.
A) VCl2
B) VCl3
C) VCl4
D) VCl5
soluzione
se 3 g di V reagiscono con 6,26 di Cl2 allora un atomo di V reagirà con X/2 Cl2
3:6,26 = 50,94 : x/2 x 71 da cui 50,94 x 6,26 / 3 = x/2 x 71 cioè 50,94 x 6,26 /3x 35,5 =X da cui X = 2,99
Quindi per ogni atomo di vanadio vi devono essere 3 Cl2 pertanto la formula deve essere VCl3
35. I lantanidi sono un insieme di:
A) 14 elementi e in essi si ha il riempimento progressivo dell’orbitale 4d
B) 10 elementi e in essi si ha il riempimento progressivo dell’orbitale 4d
C) 10 elementi e in essi si ha il riempimento progressivo dell’orbitale 4f
D) 14 elementi e in essi si ha il riempimento progressivo dell’orbitale 4f
soluzione
i lantanoidi o lantanidi sono un gruppo di 14 elementi compresi nella tavola periodica tra lantanio ed afnio ed assieme a scandio ed ittrio formano le cosiddette “Terre Rare”. Nei lantanidi gli orbitali interessati al riempimento elettronico sono gli orbitali 4f mentre gli orbitali p e d più esterni sono non occupati. Gli orbitali f conferiscono loro proprietà magnetiche e ottiche interessanti tanto che il samario è molto usato in lega con il cobalto per fabbricare magneti permanenti mentre l’ erbio è usato nella fibre ottiche. Da quanto detto si evince che la risposta corretta è D
36. Indicare, sulla base della teoria VSEPR, in quale, tra gli ioni ICl2 e NO2 , gli atomi sono allineati.
A) solo in ICl2
B) solo in NO2
C) in ambedue le specie
D) in nessuna delle due specie
soluzione
In ICl2 lo iodio è ibridizzato dsp3 quindi la geometria è una bipiramide trigonale con 3 doppietti elettronici di non legame. Nelle 5 posizioni i legami assiali risultano più lunghi in quanto risentono della repulsione di 3 coppie elettroniche a 90° (quelle sul piano equatoriale) e queste risentono ciascuna della repulsione di 2 coppie a 90° (quelle assiali), mentre tra loro sono a 120°. Le coppie di non legame (che occupano un volume maggiore nello spazio immediatamente vicino al nucleo) vanno posizionate nelle posizioni equatoriali

Una struttura di questo tipo è definita AX2E3 ( dove A è l’atomo centrale, X sono gli atomi di cloro ed E rappresenta le coppie di elettroni solitarie “lone pairs”). La forma di AX2E3 è quindi apparentemente “Lineare” ed il legame Cl-I-Cl è di 180 gradi.
Nello ione NO2- l’atomo di azoto e gli atomi di ossigeno sono ibridi SP2 e la struttura risultante è planare con angolo ONO di 120°. Pertanto la risposta corretta è A.
37. 0,229 g di una miscela di CaCO3 e CaSO4 sono trattati con un eccesso di HCl in soluzione acquosa. Dalla reazione si raccolgono 20,5 mL di CO2 gassosa, misurati in condizioni standard. Determinare la composizione in massa della miscela.
A) CaCO3 = 20,0% ; CaSO4 = 80,0%
B) CaCO3 = 80,0% ; CaSO4 = 20,0%
C) CaCO3 = 40,0% ; CaSO4 = 60,0%
D) CaCO3 = 60,0% ; CaSO4 = 40,0%
soluzione
a c.normali (273K ed 1 atmosfera) il volume occupato da una mole di un qualunque gas è 22,4 litri coè 22400 ml quindi
1mole : 22400ml =Xmoli : 20,5 ml X= 20,5/22400 = 0,000915 moli cioè 44 x 0,000915 =0,04026 grammi
inoltre CaCO3 produce CO2 quindi da X grammi se ne otterranno 0,04 g
100:44 =X : 0,04026 X= 0,04026 x 100/44 = 0,0915 g
0,229 :0,0915 =100 : X X= 39,96 quindi CaCO3 = 39,96% e 100-39,96 = 60,04% di CaSO4
38. Indicare i numeri di ossidazione possibili per l’ossigeno:
A) +2, 0, -2, -3
B) +3, +2, 0, -1
C) 0, -1, -2, -4
D) +2, 0, -1, -2
soluzione
l’ossigeno molecolare O=O essendo legato ad un atomo dello stesso tipo ha un n.o zero per ogni legame quindi in O=O si ha 0+0 cioè numero di ossidazione zero
nella molecola di H2O l’ossigeno è legato con due legami ai 2 atomi di idrogeno che sono meno elettronegativi pertanto il n.o è – 1 + -1 quindi n.o.=-2
Nell’acqua ossigenata H2O2 l’ossigeno è legato ad un altro atomo di ossigeno con un legame (valore o) e con 2 legami all’idrogeno(.1+ -1) pertanto i due atomi di O2 legati ta loro hanno un n,o, -2 quindi 1 solo atomo di ossigeno ha n.o. -1
Nella molecola OF2

l’ossigeno è legato al fluoro più elettronegativo quindi il suo n.o. è +1 + +1 =+2
si evince quindi che la risposta corretta al quesito è la D
39. Indicare, nell’ordine, i coefficienti che permettono di bilanciare la seguente reazione::
Zn +Ag3AsO4 + H2SO4 → ZnSO4 + Ag + AsH3 +H2O
A) 11, 2, 11, 11, 6, 6, 8
B) 11, 2, 11, 11, 2, 2, 8
C) 11, 2, 2, 11, 6, 2, 8
D) 11, 2, 11, 11, 6, 2, 8
soluzione
la reazione redox è la seguente:
11 [Zn° → Zn+2 +2 e
2[3Ag+ +3e → 3 Ag°
2[AsO4-3 +8H+ + 8e → As-3 + 4H2O
__________________________________
11Zn + 2 AsO4-3 + 6 Ag+ + 16H+ → 11 Zn+2 +6Ag + 2 As-3 + 8H2O
la reazione bilanciata è
11 Zn + 2 Ag3AsO4 + 11 H2SO4 →11 ZnSO4 + 6 Ag + 2 AsH3 + 8 H2O
la risposta corretta è la D
40. 12,7 grammi di una miscela costituita da FeS e FeS2 vengono fatti reagire con un eccesso di ossigeno, con formazione di Fe2O3 e SO2. Terminata la reazione si sono ottenuti 10,4 g di SO2. Si determini la composizione della miscela in percento in massa.
A) FeS = 74,9%; FeS2 = 25,1%
B) FeS = 25,1%; FeS2 = 74,9%
C) FeS = 84,0%; FeS2 = 16,0%
D) FeS = 16,0%; FeS2 = 84,0%
soluzione
poniamo la quantità di FeS = X e quella di FeS2 =Y quindi X+Y = 12,7 g
poiché da 12,7 g di miscela si ottengono 10,4 g di SO2 calcoliamo lo zolfo che era presente nella miscela da
SO2 : S = 10,4 : X da cui X= 32 x 10,4 / 64 = 5,2 g
pertanto 32 x X/88 + 64x Y/120 = 5,2
abbiamo 2 equazioni e 2 incognite e nella seconda equazione troviamo il mcm che è 88×102/8 = 1320
pertanto 480 (12,7 -Y)+ 704Y = 6846 da cui 6096 – 480Y + 704Y =6846 quindi
Y= 750 /224= 3,3 g e X = 12,7-3,3=9,4
pertanto se in 12,7: 3,3 =100:X X= 25,9 % FES2= 25,9% FeS = 74,1%
41. Un campione di X4H10 gassoso avente una massa di 0,779 g occupa un volume di 306 mL a 1,06 ·105 Pa e 20 °C. Indicare la natura chimica dell’elemento X.
A) boro
B) carbonio
C) silicio
D) germanio
soluzione
dall’equazione di stato dei gas si ha PV = n RT da cui n = PV/RT e sostituendo i valori numerici si ha:
n=1,06 x 105 x 0,306(litri) / 8,314 x 293 n= 13,3 il valore ottenuto indica che si tratti di Carbonio
42. Stabilita la geometria della specie PF3Cl2 in base alla teoria VSEPR, prevedere il numero massimo di stereoisomeri che essa può presentare.
A) 3
B) 2
C) 1
D) non si può stabilire
soluzione
secondo la teoria VESPR gli elettroni esterni sono.
P [Ne] 3s 2 3p3 5e- ( P ) + 3e- ( F ) + 2e- ( Cl ) in totale 10 elettroni = 5 coppie e 5 legami. La geometria è pertanto una bipiramide trigonale:
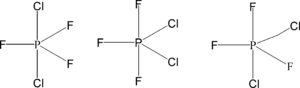
nella prima struttura i tre atomi di fluoro sono sullo stesso piano in posizione equatoriale mentre i due atomi di cloro sono sopra e sotto il triangolo formato dai 3 atomi di fluoro e sono in posizione assiale e l’atomo di fosforo è al centro del triangolo.
Un isomero è formato ponendo al posto di due degli atomi di fluoro i due atomi di cloro, quindi in questa seconda struttura 2 atomi di cloro ed 1 di fluoro sono in posizione equatoriale mentre in posizione assiale si trovano due atomi di fluoro.
Un’ altra struttura possibile vede un atomo di cloro ed uno di fluoro in posizione assiale ed un atomo di cloro con due atomo di fluoro in posizione equatoriale.
Da quanto detto i possibili isomeri di PF3Cl2 sono 3.
Risposta corretta A
43. Una reazione avviene spontaneamente a tutte le temperature solo quando:
A) ΔH > 0 e ΔS < 0
B) ΔH < 0 e ΔS > 0
C) ΔH < 0 e ΔS < 0
D) ΔH > 0 e ΔS > 0
soluzione
Un processo spontaneo è un processo (reazione) in cui il sistema rilascia ENERGIA LIBERA per passare ad uno stato energetico più basso che ne aumenta la stabilità.
Termodinamicamente si ha che  dove
dove
- ΔG è la variazione di Energia Libera di Gibbs espressa in J
- ΔH è la variazione di Entalpia espressa in J
- T è la Temperatura assoluta, espressa in K
- ΔS è la variazione di Entropia , espressa in J/K
ogni processo spontaneo comporta un aumento dell’entropia all’interno del sistema ed affinché la reazione sia spontanea, è necessario che la variazione di energia libera di Gibbs abbia un valore negativo. Pertanto se ΔS>0 e ΔH<0, il processo è sempre spontaneo e quello opposto non si realizzerà.
risposta corretta B
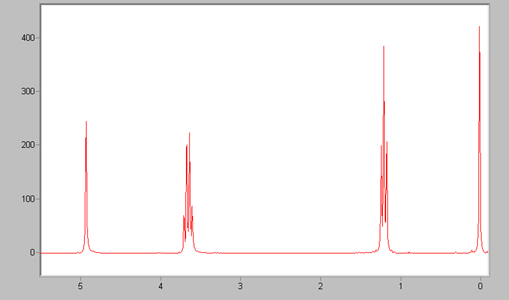
44. Quanti segnali mostra lo spettro 13C NMR del prodotto della reazione
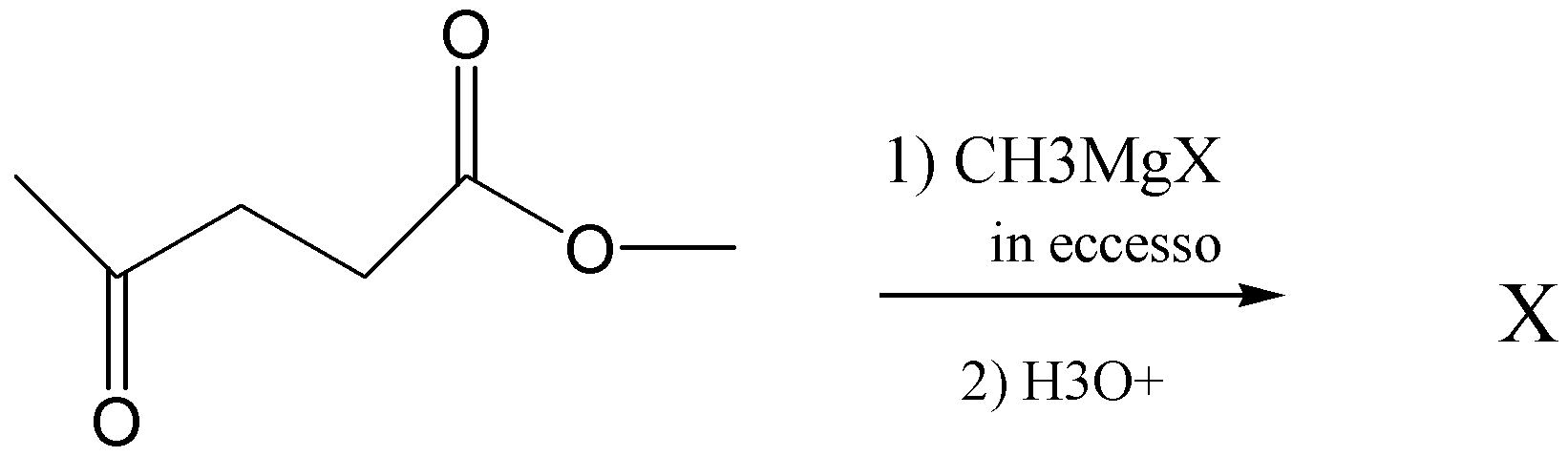
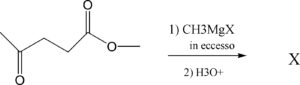
A) 5
B) 7
C) 8
D) 3
soluzione
la reazione tra un estere ed un reattivo di Grignard porta alla formazione di alcoli secondari o terziari
R-MgX + R'-CO-O-R'' → R-CO-R' + R''-O-MgXR-CO-R' + R''-O-MgX + H2O → RRR'CH-OH +R''OH + HO-MgX
nel caso in esame si ha un alcol terziario su Carbonile dell’estere ed uno secondario sul carbonile chetonico ed un alcol primario che deriva dall’ estere cioè CH3OH. I segnali NMR si riferiscono all’idrogeno del CH3 , del CH2 e del CH quindi si hanno i 3 picchi
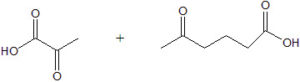
45. Individuare l’alchene che, sottoposto ad ozonolisi seguita da trattamento con perossido di idrogeno, fornisce i seguenti prodotti di reazione:
A) 1,4-dimetil-1,3-cicloeptadiene
B) 1,3-dimetil-1,4-cicloeptadiene
C) 1,2-dimetil-1,3-cicloeptadiene
D) 1,4-dimetil-1,4-cicloeptadiene
la reazione del doppio legame con ozono è definita scissione ossidativa del doppio legame poiché provoca la rottura del legame σ e di quello π con formazione di gruppi carbonilici. Queste reazioni sono utili per individuare la posizione del doppio legame in una molecola.
la molecola da cui derivano i due prodotti deve necessariamente essere l’1,2 dimetil- 1-3 ciclopentadiene
infatti:
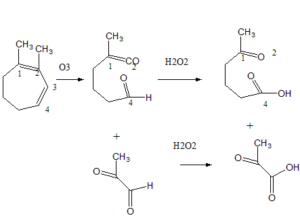
la risposta corretta è C
46. Qual è la principale differenza strutturale tra amilosio e cellulosa?
A) l’amilosio è costituito da catene non ramificate di D-glucosio tenute insieme da legami α-1,6-glicosidici, mentre nella cellulosa le unità di D-glucosio sono unite da legami β-1,6-glicosidici.
B) l’amilosio è costituito da catene non ramificate di D-glucosio tenute insieme da legami β-1,4-glicosidici, mentre nella cellulosa le unità di D-glucosio sono unite da legami α-1,4-glicosidici.
C) l’amilosio è costituito da catene ramificate di Dglucosio tenute insieme da legami α-1,4-glicosidici, mentre nella cellulosa le unità di D-glucosio sono unite da legami β-1,4-glicosidici.
D) l’amilosio è costituito da catene non ramificate di D-glucosio tenute insieme da legami α-1,4-glicosidici, mentre nella cellulosa le unità di D-glucosio sono unite da legami β-1,4-glicosidici.
soluzione
l’amilosio ha la seguente struttura

ed è un polisaccaride costituito dall’unione di centinaia di molecole( da 300 a 3000) di α-D(+)- GLUCOSIO (solitamente da 300 a 3000) unite da un legame α-1,4-glucosidico e che non sono ramificate ed assieme all’ amilopectina costituisce l’amido.
La cellulosa invece ha la seguente struttura

in cui le molecole di glucosio (300-3000) sono unite da un legame β(1→4) glucosidico
il legame glicosidico è il legame che unisce il gruppo emiacetalico di uno zucchero con un atomo di un’altra molecola.Il legame α è quello che si osserva sul piano opposto rispetto al sostituente del carbonio che nello zucchero ne determina la stereoisomeria (D o L) e che nel glucosio, è il penultimo a partire dal carbolnile, il sostituente in uno zucchero non modificato è un ossidrile (-OH). Il legame α sarà sul piano opposto rispetto all’-OH; il legame β sarà sullo stesso piano.
La risposta corretta è D
47. La seguente reazione di alchilazione di Friedel- Crafts dà un prodotto con il sostituente alchilico riarrangiato. Quale tra le seguenti affermazioni è corretta?

A) gli alogenuri alchilici primari non danno reazione di Friedel-Crafts
B) il benzene favorisce l’isomerizzazione dell’alogenuro alchilico
C) durante la reazione avviene la trasposizione di un carbocatione
D) l’isomerizzazione avviene successivamente alla formazione del prodotto non riarrangiato
soluzione
La reazione produce un derivato alchilato del benzene, tuttavia, durante la reazione si può avere una trasposizione del carbocatione (nell’esempio seguente al posto dell’OH immagina ci sia il cloro dell’esercizio). La trasposizione è un riarrangiamento molecolare che consente di ottenere un carbocatione più stabile.La trasposizione solitamente si verifica in posizione 1-2 cioè si ha lo spostamento di un gruppo metilico adiacente al carbocatione sul carbocatione stesso.

la risposta corretta è C
48. Quale tra le seguenti affermazioni è corretta?
A) l’energia di stabilizzazione per risonanza di un estere è circa 18 kcal/mol mentre quella di un’ammide è circa 10 kcal/mol
B) gli esteri e le ammidi hanno la stessa energia di stabilizzazione per risonanza
C) gli esteri e le ammidi non possono essere rappresentati da strutture limite di risonanza
D) l’energia di stabilizzazione per risonanza di un estere è circa 10 kcal/mol mentre quella di un’ammide è circa 18 kcal/mol
soluzione
la reattività rispetto alle reazioni di sostituzione al carbonile segue l’ordine

si vede che COO- è stabilizzato dalla risonanza più dell’ammide e questa è più stabilizzata dell’estere in quanto l’azoto fornisce un doppietto elettronico essendo ibrido SP3. L’energia di risonanza dell’ ammide è maggiore (18 Kcal/mole) di quella dell’estere(10Kcal/mole) pertanto la risposta corretta è D
49. Quale tipo di legame si instaura nei nucleosidi tra ribosio (o deossiribosio) e base azotata ? Il carbonio anomerico dello zucchero è unito:
A) a un atomo di azoto della base azotata con legame β-N-glicosidico
B) a un atomo di azoto della base azotata con legame α-N-glicosidico
C) a un atomo di carbonio della base azotata
D) tramite un atomo di ossigeno alla base azotata con legame β-glicosidico
soluzione
Un nucleoside è un composto chimico formato da un pentoso quale D-Ribosio o 2- deossiribosio e da una base purinica (adenina, guanina) o pirimidinica (citosina, uracile, timina) . Il legame che si forma tra lo zucchero e l’azoto della base azotata è un legame B- N-glicosidico. Un nucleoside, per aggiunta di un gruppo fosfato costituisce il monomero detto Nucleotide che forma la base del DNA e dell’RNA a seconda che lo zucchero sia il D-Ribosio o il 2-deossiribosio.
la risposta corretta è A
50. Quale dei seguenti prodotti sarà ottenuto per trattamento del glicerolo con acido solforico a caldo?
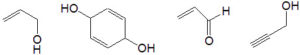
1 2 3 4
A) 1
B) 2
C) 3
D) 4
soluzione
il glicerolo la cui formula è :
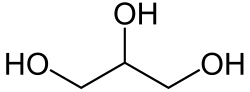
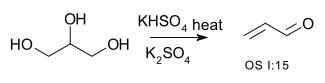
contiene tre gruppi ossidrilici e sottoposto all’azione dell’acido solforico provoca una disidratazione con formazione di un doppio legame e di un gruppo aldeidico che nel caso in esame è il composto n. 3. Inoltre il glicerolo può reagire con KHSO4 a caldo per formare il chetone:
51. La sintesi malonica, sfruttando la spiccata acidità dell’estere malonico, consente di preparare derivati mono e di sostituiti dell’acido acetico. A questo proposito, individuare quale delle molecole sotto riportate può essere ottenuta per sintesi malonica.
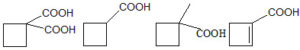
1 2 3 4
A) 1
B) 2
C) 3
D) 4
soluzione
normalmente la sintesi malonica è la seguente:
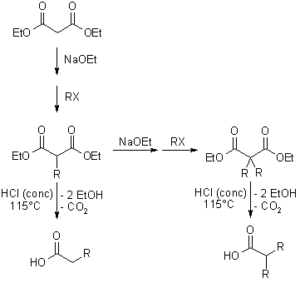
gli esteri malonici sono più acidi dei semplici esteri così è possibile l’alchilazione via formazione di enolato promossa da una base di media forza quale etossido di sodio. Successivamente esso reagisce con un alogenuro alchilico ma è necessario usare un eccesso di estere per prevenire la dialchilazione che invece porta alla formazione di acidi carbossilici. La dialchilazione, inoltre, può portare alla formazione di ciclobutani:
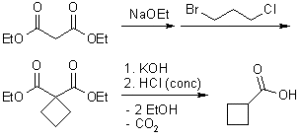
si deduce che la risposta esatta è C
52. Individuare quale specie in ciascuna delle seguenti coppie è il miglior nucleofilo.
1) SH– o OH– 2) NH3 o PH3 3) Br– o F– 4) CH3NH– o CH3NH2
A) 1: OH–; 2: PH3; 3: Br–; 4: CH3NH–
B) 1: SH–; 2: PH3; 3: F–; 4: CH3NH–
C) 1: OH–; 2: NH3; 3: Br–; 4: CH3NH2
D) 1: SH–; 2: PH3; 3: Br–; 4: CH3NH
soluzione
Nella tavola periodica, si osserva che la basicità aumenta da sinistra a destra e quindi anche la nuclofilicità. Tutto però dipende dal solvente. Nei solventi protici la nucleofilicità non aumenta come la basicità ma al contrario essa diminuisce.
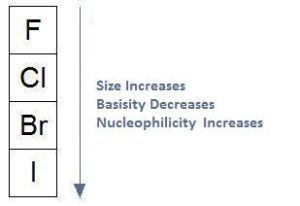

i nucleofili carichi negativamente sono migliori nucleofili di quelli non carichi. Inoltre, con l’aumento delle dimensioni di un atomo la basicità diminuisce mentre aumenta la nucleofilicità:
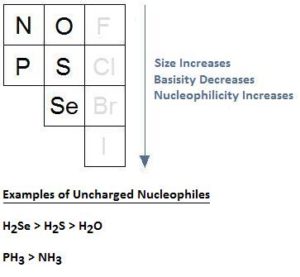
da quanto esposto la risposta corretta è D cioè i migliori nuclefili nelle coppie indicate sono:
1: SH– miglore di OH- ; 2: PH3 migliore di NH3 3: Br– migliore di F- e 4: CH3NH migliore di CH3NH2
53. Osservando la seguente reazione di condensazione aldolica, individuare l’affermazione corretta:
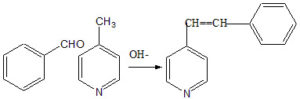
A) gli idrogeni sul metile legato alla posizione 4 della piridina hanno un’acidità paragonabile a quella degli idrogeni in α dei chetoni, a causa dell’effetto elettron-donatore per risonanza dell’azoto
B) la reazione non risulta possibile a causa della degradazione della benzaldeide nelle condizioni descritte
C) gli idrogeni sul metile legato alla posizione 4 della piridina hanno un’acidità paragonabile a quella degli idrogeni in α dei chetoni, a causa dell’effetto elettron-attrattore per risonanza dell’azoto
D) la benzaldeide è inizialmente trasformata nella specie nucleofila della reazione
soluzione
il gruppo CH3-> è un gruppo elettron-donatore e quando è legato all’anello benzenico i suoi atomi di idrogeno possiedono una leggera acidità che viene ulteriormente aumentata se l’anello è quello della piridina. Infatti l’azoto possiede caratteristiche elettron-attrattive poichè il doppietto elettronico contribuisce alla delocalizzazione sull’anello per risonanza ed attira ulteriormente verso l’anello gli elettroni del legame CH del gruppo metilico in posizione para.
Si deduce che la risposta corretta è C
54. Indicare se ciascuna delle seguenti reazioni è un’ossidazione, una riduzione o nessuna delle due:
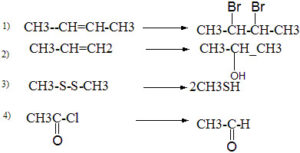
A) 1 = ox; 2 = ox; 3 = rid; 4 = rid
B) 1 = rid; 2 = ox; 3 = rid; 4 = nessuna delle due
C) 1 = ox; 2 = nessuna delle due; 3 = rid; 4 = rid
D) 1 = nessuna delle due; 2 = ox; 3 = rid; 4 = rid
soluzione
ricordiamo che un’ossidazione corrisponde ad un aumento del numero di ossidazione di un atomo ed una riduzione corrisponde ad una diminuizione. (il numero di ossidazione di un atomo è un numero che si attribuisce ad un atomo a seconda che sia legato con un legame a 2 elettroni ad un atomo con elettronegatività maggiore (si assegna+1) o minore (si assegna -1), e se è legato ad un atomo dello stesso tip si assegna 0)
Osservando il composto 1) l’atomo di C legato al doppio legame ha numero di ossidazione zero essendo legato ad un atomo dello stesso tipo, ed il Bromo Br2 con cui reagisce, da numero di ossidazione zero passa a numero di ossidazione -1 ed il carbonio del doppio legame passa a numero di ossidazione +1 . Si tratta quindi dell’ossidazione del carbonio.
La seconda reazione non è nè un’ossidazione nè una riduzione trattandosi di una semplice reazione di somma, infatti l’H2O si dissocia in H+ ed OH- che si sommano al doppio legame.
Nella terza reazione lo Zolfo passa da numero di ossidazione Zero a numero di ossidazione -1 (infatti H ha negatività minore dello zolfo) per cui si tratta di una riduzione.
Nella quarta reazione, l’idrogeno sostituisce il cloro, e siccome il cloro ha elettronegatività maggiore dell’idrogeno il C a cui è legato riduce il suo numero di ossidazione, per cui si tratta di una riduzione.
La risposta corretta è quindi C
55. Le reazioni di Friedel-Crafts sono tra le più lente sostituzioni elettrofile aromatiche (SEAr).
Pertanto, se sull’anello benzenico è presente un gruppo disattivante, non procede né l’acilazione né l’alchilazione. Nonostante il gruppo amminico sia un forte attivante delle SEAr l’anilina non riesce a dare le reazioni di Friedel-Crafts. Scegliere tra le seguenti affermazioni quella corretta:
A) il gruppo amminico reagisce con l’alogenuro acilico/alchilico impedendo la reazione di SEAr
B) la reazione tra il gruppo amminico e l’acido di Lewis rende il gruppo NH2 disattivante, impedendo
la reazione
C) l’acido di Lewis catalizza l’ossidazione del gruppo NH2 a gruppo NO2
D) l’acido di Lewis promuove la polimerizzazione dell’anilina
soluzione
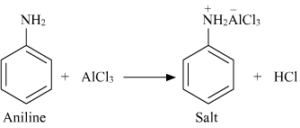
come si vede, la reazione di Friedel Craft in tal caso non può avvenire perchè AlCl3 (che viene usato come catalizzatore) essendo elettron-deficiente agisce come base di Lewis ed attacca il doppietto elettronico dell’azoto per formare un complesso insolubile che precipita rendendo pertanto il gruppo NH2 disattivante rispetto all’anello e la reazione di Friedel Craft non può avvenire.
La risposta corretta è B
56. Anche se in una reazione SN1 di un alogenuro chirale dovremmo aspettarci racemizzazione completa, spesso si ottiene in quantità maggiore il prodotto con configurazione invertita. Questa racemizzazione parziale nelle SN1:
A) è favorita da nucleofili ingombranti
B) è favorita da nucleofili poco ingombranti
C) è un fenomeno casuale
D) è favorita dalla formazione di coppie ioniche intime
soluzione
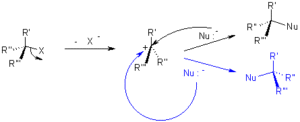
In questa reazione il nucleofilo compete con il gruppo uscente e questo ci consente di comprendere quali debbano essere le proprietà del nucleofili e del gruppo uscente. Nelle reazioni SN1 si forma un carbocatione planare e l’attacco nucleofilo può avvenire da ambedue i lati e la reazione porta a racemizzazione. Il concetto di “coppia ionica” fu introdotto da Winstein che indicò che le differenze di velocità, stechiometria ed effetto dei sali richiedessero due intermedi tra le specie non dissociate (R-X) e le specie completamente dissociate (R+ ed X–). Inizialmente si forma un carbocatione ed il suo controione che sono molto vicini tra loro, questa coppia è definita coppia ionica intima. Il solvente però, agisce sui due ioni e lentamente li separa dando origine ad una coppia ionica in cui gli ioni cominciano a separarsi. Con il passare del tempo un numero sempre più alto di molecole del solvente si insinuano tra i due ioni fino a raggiungere una situazione in cui il carbocatione è libero e lontano dall’anione e le due specie sono del tutto dissociate.Questo significa che la reazione è favorita dalla formazione iniziale di coppie di ioni intime che determinano la formazione di prodotto con preponderanza di un certo tipo in quanto il nucleofilo entra prevalentemente da una sola parte e solo dopo, quando si formano le coppie ioniche libere, il carbocatione è attaccabile da ambedue i lati.
La risposta corretta è D
57. L’acetaldeide reagisce con il 2-metil-1,3 propandiolo in catalisi acida formando due acetali isomeri, di cui uno è il prodotto principale. Scegliere l’affermazione corretta:
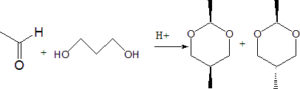
A) le due molecole sono chirali e l’isomero trans è il prodotto principale
B) le due molecole sono achirali e l’isomero trans è il prodotto principale
C) l’isomero trans è chirale e l’isomero cis è il prodotto principale
D) l’effetto elettronico degli ossigeni nel ciclo fa prevalere l’isomero trans
soluzione
le molecole ottenute sono achirali ( affinché una molecola sia chirale è necessario che vi sia un C asimmetrico cioè legato a 4 atomi o gruppi atomici diversi). La reazione di ciclizzazione porta alla formazione di un diossano ma la reazione favorita conduce prevalentemente al composto trans che è energeticamente e stericamente più stabile.
58. Individuare il dichetone che, per trattamento con KOH in etanolo, porta alla formazione del seguente chetone α,β-insaturo
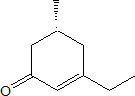
A) (S)-5-metil-3,7-nonandione
B) (R)-4-metil-2,6-ottandione
C) (S)-4-metil-2,6-ottandione
D) (R)-4-metil-1,2-ottandione
soluzione
la differenza tra composto R ed S si riferisce alla convenzione di attribuire secondo alcune regole la posizione di alcuni sostituenti in un atomo di carbonio asimmetrico:
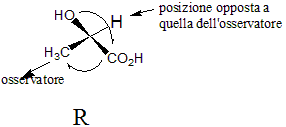
si posizionano i sostituenti secondo le priorità dettate dalle regole E-Z (le lettere E e Z, si riferiscono a due vocaboli tedeschi entgegen = opposto e zusammen = insieme) e si pone il gruppo atomico o l’atomo a più bassa priorità lontano dall’osservatore. Più è alto il numero atomico dell’atomo legato al carbonio del doppio legame, più alta è la sua priorità (Br > Cl > O > N > C > H); se due atomi uniti al carbonio hanno la stessa priorità, si prosegue lungo la catena dei gruppi sostituenti fino al punto in cui la priorità dei due gruppi differisce. Stabilita pertanto la priorità, e posizionato quello a priorità più bassa lontano dall’osservatore,si considera il gruppo con priorità successiva a quella più bassa e si ruota portando quest’ultimo nella posizione del gruppo a priorità più alta passando per quello intermedio. Se la rotazione è oraria allora la molecola ha conformazione R altrimenti ha conformazione S.
Nell’esempio sopra, l’H ha priorità più bassa e si pone lontano dall’osservatore. La priorità successiva è quella dell’OH poi quella di COOH e quindi CH3, Perchè OH raggiunga la posizione di CH3 passando per COOH è necessario ruotare verso destra (senso orario) perciò la molecola ha conformazione R.
Nel caso dell’esempio la molecola di partenza cioè il 4-metil-2,6-ottandione ha conformazione S essendo il prodotto a conformazione S infatti nella posizione 6 troviamo un atomo di idrogeno un CO un CH3 e la rotazione è verso sinistra.
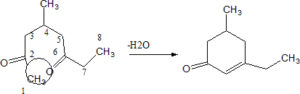
in relazione a quanto sopra la risposta corretta è C
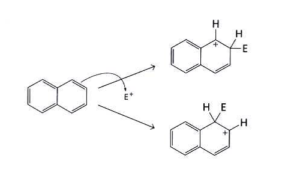
59. Il naftalene dà facilmente reazioni di sostituzione elettrofila aromatica e la posizione più reattiva è la posizione 1. Qual è la ragione di questa fatto?
A) l’intermedio formato nella reazione con attacco in posizione 1 è stabilizzato da più strutture di risonanza
B) pur essendo stabilizzato dallo stesso numero di strutture di risonanza, l’intermedio formato nella reazione con attacco in posizione 1 è rappresentato da strutture più stabili
C) la regioselettività è governata dagli effetti sterici
D) l’attacco alla posizione 2 potrebbe favorire la perdita dell’aromaticità del naftalene
soluzione
nella terza figura è rappresentata l’energia di localizzazione ( LE ) delle posizioni 1 e 2 definita come l’energia del legame π richiesta per attaccare un protone o un elettrofilo in un sistema coniugato.Le posizioni con LE più basso sono più facilmente attaccabili ed esiste un’eccellente correlazione tra l’energia di localizzazione e le reattività elettrofile.
la posizione 1(α) è pertanto più reattiva della posizione 2 (β) poichè l’intermedio che si forma in posizione 1 è più stabile per risonanza.
La risposta corretta è B
60. Un esempio di sostituzione elettrofila aromatica è la reazione di diazocopulazione dei fenoli.Questa reazione ha una velocità maggiore se condotta in soluzione debolmente alcalina, ma a pH > 10 si blocca. Quale può essere la ragione di questo fenomeno?
A) in condizioni fortemente basiche lo ione fenossido tende a polimerizzare
B) in condizioni fortemente basiche prevale la sostituzione nucleofila aromatica
C) in condizioni fortemente basiche il sale di arendiazonio si trasforma in un prodotto non reattivo
D) nessuna delle risposte precedenti è corretta
soluzione
Il meccanismo della reazione di copulazione è in realtà una sostituzione elettrofila su un anello aromatico attivato da una base che agisce da catalizzatore. La funzione della base é quella di formare lo ione fenato, piu’ reattivo nei confronti di un attacco elettrofilico, ciò avviene a PH leggermente basico.
Tuttavia, l’uso di una elevata quantità’ di base, quindi a PH basici elevati quale ad esempio PH 10, può compromettere la reazione sino a bloccarla in quanto si forma acido diazoico Ar−N=N−OH. La base eccessiva quindi sottrae elettrofilo alla reazione che alla fine si blocca.
In definitive il pH leggermente basico, ottenuto dalla sequenza delle operazioni, deve consentire la salificazione del fenolo senza abbassare troppo la concentrazione dell’ elettrofilo libero.
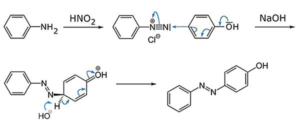
la risposta corretta è C







 dove
dove