STRUTTURA DELL’ATOMO : L’ELETTRONE, IL PROTONE ED IL NEUTRONE
Settembre 20, 2024
L’ATOMO ED I SUOI COMPONENTI
Sappiamo che ogni singola specie chimica o elemento, è rappresentata da un insieme di particelle dette atomi della specie chimica in esame. Tutti gli atomi posseggono la stessa struttura e differiscono l’un l’altro per il numero ed il tipo di particelle di cui sono costituiti.
Le particelle atomiche possono essere classificate in due grandi categorie: ADRONI e LEPTONI
ADRONI SONO:
il protone
il neutrone
LEPTONI SONO :
elettrone
positrone,
neutrino
GLI ADRONI
sono a loro volta costituiti da particelle piu’ piccole dette QUARKS
I LEPTONI
sono invece considerati “puntiformi”
LA SCOPERTA DELLE PARTICELLE ATOMICHE
L’ ELETTRONE
Intorno al 1870 diversi fisici quali Nicholson,Carlisle,Davy, Berzelius, Faraday compivano indipendentemente ricerche molto intense sull’elettricità. A quel tempo era nota l’esistenza di due tipi di carica elettrica una positiva indicata col segno + ed una negativa indicata col segno –.
Coulomb aveva,a sua volta, scoperto che cariche di segno opposto si attraggono e cariche di segno uguale si respingono con una forza proporzionale al prodotto tra le cariche diviso il quadrato della distanza.
F= K Q1 x Q2 / r2 dove
K= costante di proporzionalità dal valore
K= 1/4π ε0
(ε0 = costante dielettrica del mezzo)
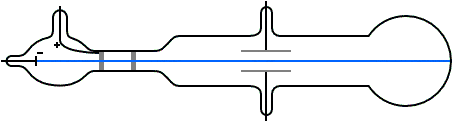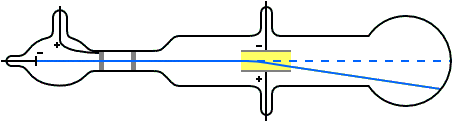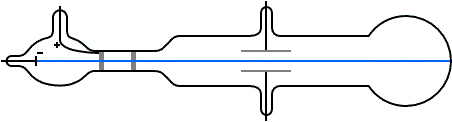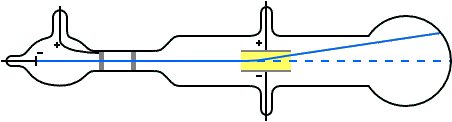
Una volta scoperta la corrente elettrica, i fisici cominciarono a studiare i fenomeni conseguenti al passaggio di corrente sia nei gas che nei liquidi oltre che nei metalli. J.J. Thomson fu il primo a studiare il comportamento delle cariche elettriche nei gas utilizzando uno strumento chiamato tubo a raggi catodici che è mostrato in figura
Se al posto del campo elettrico si usava un campo magnetico di intensità H si osservava anche in questo caso la deviazione del raggio ed invertendo la polarità del campo magnetico si invertiva anche la direzione del raggio deviato.A questo punto guarda il video
[embedyt] http://www.youtube.com/watch?v=NZ4-YJWjZ4s[/embedyt]
CALCOLO DEL RAPPORTO CARICA MASSA DELL’ELETTRONE
Il procedimento è abbastanza semplice. Si applica al raggio di particelle cariche negativamente un campo magnetico di intensità H. questo fa deviare il raggio dal cammino in linea retta provocandone la curvatura per cui le particelle sono sottoposte ad una forza centrifuga. Quindi abbiamo i seguenti dati:
Campo magnetico = H = e x V
e = carica di ogni particella
v= velocità di ogni particella
FORZA CENTRIFUGA = F = mv²/r
essendo la forza centrifuga bilanciata dal campo magnetico si può scrivere :
Forza centrifuga = Campo magnetico applicato
mv²/r = H e v
mv² = H e v r
mv = H e r
e/m = v/r H
poichè H è noto, ed r è il raggio di curvatura del fascio di particelle,
dobbiamo conoscere v per questo applichiamo il campo elettrico in modo da riportare il raggio in linea retta togliendone la curvatura, cioè bilanciando esattamente il campo magnetico H . Essendo il campo elettrico applicato pari a E= X e ed il campo magnetico pari a H e v si ha:
Hev = X e
V= X / H
e quindi sapendo che e/m = v /rH sostituendo a v il rapporto X/H è stato facile per Thomson calcolare il rapporto e/m della particella negativa che chiamò elettrone
e / m = – 1,76 x 108 coulomb/grammo
il valore esatto oggi accettato è:
-1,7588 x 10¹¹ coulomb/ Kg
-1,7588 x 108 coulomb/grammo
questo valore veniva ottenuto da Thomson anche se si cambiava la natura del catodo o del gas contenuto nel tubo e ciò era una conferma che quella particella negativa scoperta, chiamata ELETTRONE, era una particella fondamentale della materia.
MISURA DELLA CARICA DELL’ELETTRONE
Thomson, pur avendo ottenuto il valore del rapporto tra carica e massa dell’elettrone, non riuscì a calcolare nè la sua carica nè la sua massa. La carica dellìelettrone è stata calcolata invece da Millikan che realizzò un esperimento che puoi vedere in questo filmato.[embedyt] http://www.youtube.com/watch?v=UMYqVddHQ5s[/embedyt]
IL PROTONE
Il fatto che fosse stato scoperto l’elettrone cioè l’unità di carica negativa, presente in tutta la materia elettricamente neutra, portò gli scienziati a supporre che lamateria fosse costituita anche da particelle cariche positivamente. La conferma dell’esistenza di cariche positive si ebbe mediante un tubo di scarica, cioè un tubo di vetro ad una estremità del quale si trova l’elettrodo positivo(ANODO) mentre l’elettrodo negativo (CATODO) è costituito da un disco forato come in figura

all’interno del quale è contenuto un gas a bassa pressione.Si osservava che,oltre ai raggi catodici che si dirigevano in linea retta dal catodo{-) al1’anodo(+), avevano origine anche dei raggi, detti “CANALE”, che avevano origine all’anodo e muovendosi in linea retta, attraversavano i fori presenti sul catodo per giungere all’altra estremità del tubo.
Anche per questo nuovo tipo di particelle , usando gli stessi metodi adoperati per studiare i raggi Catodici, si individuò il rapporto carica/massa e si osservò che tale rapporto era molto più piccolo di quanto non fosse il rapporto e/m per l’elettrone e ciò indicava pertanto una massa maggiore di quella dell’elettrone. Si osservò, inoltre, al contrario di quanto avveniva per l’elettrone, che il rapporto e/m variava al variare del gas introdotto nel tubo. Se il gas in esame era l’idrogeno, si notava che il rapporto e/m era il più grande che si potesse ottenere e questo indicava che la massa della particella doveva essere la più piccola tra quelle osservate.
Studi successivi, portarono a stabilire la carica di questa particella ottenuta da un tubo di scarica contenente idrogeno e si osservò un valore
e = +1,60-10-19 coulombs
cioè un valore esattamente uguale a quello ottenuto per l’elettrone con la sola differenza che in questo caso la carica della particella era positiva. La massa calcolata invece risultava essere
m = 1,67235.10-27 Kg
La particella positiva ottenuta nel tubo di scarica contenente Idrogeno venne chiamata protone. Tutti gli altri gas studiati nel tubo fornivano valori di rapporto carica/ massa multipli di quello ottenuto per l’Idrogeno per cui era logico pensare che tutti i gas studiati fossero formati da protoni.
Il PROTONE ED I QUARKS
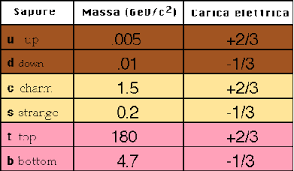
Oggi sappiamo che un protone non è una particella elementare infatti si è scoperto che è costituito da particelle più piccole dotate di carica frazionaria dette quarks. I quarks sono 6 e vengono chiamati nel seguente modo
 cioè UP (SU) DOWN (GIU’) CHARM (FASCINO) STRANGE (STRANO) TOP (ALTO) bOTTOM(BASSO). Ogni quark possiede una massa red una carica :
cioè UP (SU) DOWN (GIU’) CHARM (FASCINO) STRANGE (STRANO) TOP (ALTO) bOTTOM(BASSO). Ogni quark possiede una massa red una carica :
il protone è costituito da 2 quarks UP ed 1 Quark DOWN
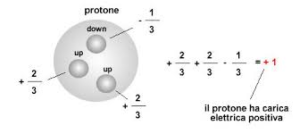
la sua carica è facilmente calcolata dal valore della carica dei quarks che lo compongono e cioè
2 UP = +2/3 +2/3
1 DOWN = – 1/3
pertanto la carica del PROTONE = 2/3 + 2/3 – 1/3 = 3/3 = +1
IL NEUTRONE
Nel corso degli studi di Rutherford nel 1912 si osservò che l’atomo di elio (simbolo He ) possedeva una carica positiva doppia rispetto a quella del protone , ma la sua massa che ci si attendeva essere il doppio di quella del protone, era invece quattro volte rispetto a quest’ultimo. Questo fece ipotizzare che esistessero altre particelle oltre al protone che fossero prive di carica ma che influenzassero la massa .La conferma dell’esistenza di questa nuova particella si ebbe solo venti anni più tardi per merito di James Chadwick e venne chiamata NEUTRONE. Oggi sappiamo anche che , il neutrone è costituito da 3 quarks come il protone, solo che in questo caso si tratta di 2 quarks Down ed 1 UP. Essendo un quark down di carica -1/3 ed un quark up di carica +2/3 allora la carica totale è -1/3 -1/3 + 2/3 = 0.
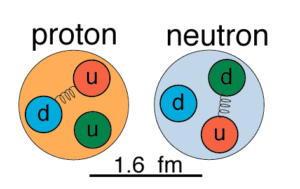
Tutti gli atomi sono costituiti da protoni ed elettroni contenuti in quantità uguali, per cui le cariche elettriche negative degli elettroni sono bilanciate dalle cariche positive dei protoni pertanto gli atomi sono elettricamente NEUTRI.
IL NUMERO DI PROTONI E’ DETTO NUMERO ATOMICO E SI INDICA CON LA LETTERA Z
IN NATURA, ALCUNI ATOMI POSSIEDONO LO STESSO NUMERO DI ELETTRONI E DI PROTONI MA HANNO IN PIU’ UNO O PIU’ NEUTRONI.
OVVIAMENTE LA SPECIE CHIMICA E’ IDENTICA MA DIFFERISCONO TRA LORO NEL PESO.
Per esempio, l’Idrogeno simbolo H possiede 1 protone ed ha quindi un numero atomico Z=1 ma esiste un tipo di idrogeno che assieme al protone possiede anche un neutrone per cui, pur essendo il numero atomico sempre Z= 1 differisce per il peso che è 2 e si chiama perciò DEUTERIO(simbolo D). Un altro tipo di idrogeno contiene 2 neutroni ed 1 protone ed il peso è 3 e viene chiamato TRIZIO il cui simbolo è T.
Il comportamento chimico sia di H che di D e T è identico ma differiscono tra loro nel comportamento fisico. D2O ( detta acqua pesante) nel comportamento chimico è infatti simile ad H2O ma per le caratteristiche del Deuterio ha applicazioni fisiche diverse dall’H2O infatti ad esempio viene usata nei reattori nucleari.
Gli elementi che possiedono neutroni in quantità prossime a quelle dei protoni sono stabili, ma quando il numero di neutroni supera di molto il numero di protoni allora l’atomo è instabile oppure si osserva un decadimento radioattivo ed in un periodo più o meno lungo si modifica spontaneamente mediante processi che modificano il rapporto tra protoni e neutroni.
GLI ATOMI CHE POSSIEDONO LO STESSO NUMERO ATOMICO Z MA HANNO UNO O PIU’ NEUTRONI VENGONO CHIAMATI ISOTOPI .
PER ESEMPIO IL DEUTERIO D E’ UN ISOTOPO DELL’IDROGENO COSI’ COME IL TRIZIO PERCHE’ POSSIEDONO LO STESSO NUMERO ATOMICO Z=1 MA HANNO UN NUMERO DI NEUTRONI DIVERSO. l
la somma tra numero di protoni e numero di neutroni viene definito:
NUMERO DI MASSA
i neutroni modificano la massa dell’atomo.
Il numero di massa indicato con A, viene scritto in alto a sinistra del simbolo.
Ad esempio l’ossigeno in natura esiste nelle tre forme:
16O 8 protoni ed 8 neutroni abbondanza paria a 99,759 %
17O 8 protoni e 9 neutroni abbondanza pari a 0,0374%
18O 8 protoni e 10 neutroni abbondanza 0,2039 %
il cloro a sua volta esiste nelle due forme
35 Cl 17 protoni e 18 neutroni abbondanza pari a 75,77%
37Cl 17 protoni e 19 neutroni abbondanza pari a 24,23 %
il bromo ha due isotopi:
79Br 35 protoni e 44 neutroni abbondanza pari a 50,54%
81Br 35 protoni e 46 neutroni abbondanza pari a 49,46%
ESERCIZI
1)INDICA QUANTI PROTONI NEUTRONI ED ELETTRONI SONO PRESENTI NEI SEGUENTI ATOMI:
12C 208 Pb 13C 96 Mo 116Cd
per calcolare il numero di neutroni ricordiamo che il carbonio Z=6 possiede 6 elettroni (ed ovviamente 6 protoni essendo elettricamente neutro) mentre il numero di massa A =12 perciò il 12C possiede 12- 6 =6 quindi possiede:
6 neutroni, 6 protoni e 6 elettroni.
il 208 Pb possiede Z= 82 elettroni e numero di massa A= 208 perciò il numero di protoni è : 208- 82 =126 neutroni ed ovviamente 82 protoni
il 13C ha numero di massa A= 13 ma Z=6 (numero di elettroni o protoni) perciò possiede 13-6 = 7 neutroni
il Molibdeno 96 Mo possiede numero di massa A=96 e Z= 42 elettroni (o protoni) perciò possiede 96-42 neutroni
Il cadmio= 116Cd possiede numero di massa A=116 e Z=48 elettroni (o protoni) pertanto possiede 116-48 =68 neutroni
2) INDICARE QUANTI ELETTRONI PROTONI E NEUTRONI POSSIEDONO I SEGUENTI IONI:
K+ (Z=19 A=19 ) Ti+3 (Z= 22 A=48) Cd+2 ( Z=48 A= 112) Cl– (Z=17 A= 35)
Se-2 (Z=34 A= 80)
SOLUZIONE
K+ HA UNA CARICA POSITIVA E CIO’ SIGNIFICA CHE HA PERSO UN ELETTRONE MENTRE IL NUMERO DI PROTONI RIMANE INVARIATO PERCIO’ IL NUMERO DI PROTONI E’ INDICATO DA Z=19 MENTRE IL NUMERO DI ELETTRONI E’
19-1 =18 ed I NEUTRONI SONO 19-19=0
LO IONE TITANIO Ti+3 (Z= 22 A=48) HA 3 ELETTRONI (CARICHE NEGATIVE ) IN MENO PER CUI POSSIEDE
22 PROTONI
22-3 = 19 ELETTRONI
A-Z NEUTRONI CIOE’
48-22 =26 NEUTRONI
LO IONE CADMIO Cd+2 ( Z=48 A= 112) AVENDO 2 CARICHE POSITIVE EVIDENTEMENTE HA 2 ELETTRONI IN MENO RISPETTO AI PROTONI PERCIO’
GLI ELETTRONI SONO 48 -2 =46
PROTONI = 48
NEUTRONI 112 -48 = 64
LO IONE CLOROCl– (Z=17 A= 35)POSSIEDE UNA CARICA NEGATIVA E CIO’ SIGNIFICA CHE HA UN ELETTRONE IN PIU’ RISPETTO AI PROTONI PERCIO’
PROTONI=Z=17
ELETTRONI = Z+1 =18
NEUTRONI = A-Z= 35-17 =18
LA MASSA DEGLI ATOMI ED IL PESO ATOMICO
Le masse dei singoli atomi sono generalmente comprese tra 10-22 10-24 grammi, essendo questo il risultato della somma dei pesi dei singoli componenti cioè protoni elettroni e neutroni.Calcoli chimici effettuati con numeri così piccoli, oltre ad essere poco pratici, sono anche complicati per cui è stato scelto un sistema più pratico per indicare il peso degli atomi anche se questi nuovi pesi non sono quelli reali (assoluti) ma pesi atomici convenzionali. Infatti, si è stabilito per convenzione di utilizzare come unità di peso il CARBONIO 12 a cui è stato attribuito un peso convenzionale di 12 unità di massa atomica (u.m.a) e si è attribuito agli altri atomi un peso relativo a quello del carbonio 12.
Il peso reale di una unità di massa atomica è quindi 1 /12 del peso del carbonio cioè 19,925 x 10-24 / 12 =1,66 x 10-24 g. che è un’unità molto piccola. Il peso convenzionale del carbonio è invece pari a 12 u.m.a.
Pertanto,dire ad esempio che l’ Idrogeno ha peso di 1 u.m.a. significa che la sua massa è 1/12 della massa del Carbonio 12 . Dire che lo Iodio ha una massa pari a 126,90 u.m.a. significa dire che la sua massa è 126,90 volte 1/12 della massa del carbonio 12. L’atomo di azoto ha una massa atomica di 14 u.m.a. quindi possiede una massa 14 volte 1/12 di quella del Carbonio 12.Quindi 1/12 rappresenta l’unità di massa atomica.
Immagina di avere una bilancia e di dover pesare un atomo:
su uno dei piatti poni l’elemento da pesare es l’Azoto e sull’altro si pongono i pesi che si utilizzano per la pesata.In questo caso ogni peso è costituito da una unità di misura che è 1/12 del peso del Carbonio che pesa 12 unità, quindi per equilibrare la bilancia occorre usare 14 unità di misura ognuna delle quali pesa 1/12 del C.
Sono stati calcolati i pesi atomici di tutti gli elementi e sono stati espressi in u.m.a. che essendo riferiti al Carbonio prendono il nome di PESI ATOMICI RELATIVI.
Nella tavola periodica di Mendelayev ogni atomo è rappresentato dal suo simbolo ed in alto a sinistra vi è il numero atomico A (numero di protoni o elettroni) ed in basso il suo peso atomico. Il carbonio è rappresentato da
6C
12,01115
Puoi notare che nella tavola il peso atomico del C 12 non è esattamente 12,0 come è stato detto prima, ma è 12,01115 e ciò perchè nella tavola viene espresso il VALORE MEDIO dei pesi atomici dei vari isotopi presenti in natura.
LA MEDIA DEI PESI ATOMICI DEGLI ISOTOPI DI UN ELEMENTO
SE SI CONOSCE LA MASSA APPROSSIMATA DI OGNI ISOTOPO E LA SUA PERCENTUALE IN NATURA E’ POSSIBILE IL CALCOLO DEL VALORE MEDIO DEL PESO ATOMICO.
ESEMPIO:
ELEMENTO |ISOTOPO | MASSA x % | MASSAx % /100 | SOMMA
CARBONIO| 12C | 12,00 x 98,90 |11,868 |11,868
| 13C | 13,0034x 0,011 | 0,143 | 0,143
valore medio = 12,011
IL DIFETTO DI MASSA
Se consideriamo l’isotopo 12 del Carbonio sappiamo che contiene 6 protoni e 6 neutroni. Il calcolo della massa è
6 x 1,00814 (peso relativo) = 6,04884 PESO RELATIVO DEI PROTONI
6 X 1,00897 (peso relativo)= 6,05382 PESO RELATIVO ELETTRONI
TOTALE PESO = 12,10266 u.m.a.
Sperimentalmente si trova invece un peso effettivo di 12,0038 e la differenza tra
PESO CALCOLATO – PESO SPERIMENTALE= DIFETTO DI MASSA
nel caso del carbonio pertanto, il difetto di massa è paria 12,10266- 12,0038 = 0,09886 u.m.a. Il motivo di questa discordanza è che quando i 6 protoni ed i 6 neutroni si uniscono per formare un tutt’uno che costituisce il nucleo dell’atomo, si produce energia secondo l’equazione di Einstein cioè
E= mC²
dove C è la velocità della luce 3 x 10¹º cm /sec m è la massa ed E è l’energia che si sviluppa . Per il carbonio dell’esempio si ha uno sviluppo di energia pari a E= 2,14 x 10¹² calorie.
Questa energia in effetti è l’energia che lega le 12 particelle (6 protoni e 6 neutroni) del carbonio 12 ed ovviamente l’energia con cui si lega una sola particella è data da E/12 cioè 2,14 x 10¹² /12 .
qualche esercizio
gli isotopi del ferro
55 Fe ed 56Fe
possiedono un peso atomico rispettivamente di 55,000 u.m.a. e 55,85 u.m.a.
Le % in natura del 56Fe è l’85 % del totale . Calcola il peso atomico medio.
soluzione
se 56Fe è l’85 % allora 55 Fe sarà 100-85 =15%
moltiplichiamo il peso atomico x la % e dividiamo per 100
55,000 x 0,15 = 8,2500
55,85 x 0,85 = 47,6225
totale = 8,25000 + 47,6225 = 55,8725 u.m.a.
la somma fornisce il valore medio del peso atomico dei due isotopi del ferro.