Giochi della Chimica 2024 Fase regionale ‒ Classe A
Novembre 25, 2024
1. DALLA REAZIONE DELL’OSSIDO DI CALCIO CON L’ACQUA SI OTTIENE:
A) UN ACIDO ORGANICO
B) ACQUA OSSIGENATA E CALCIO
C) IDROSSIDO DI CALCIO
D) IDRURO DI CALCIO E PEROSSIDO DI CALCIO
SOLUZIONE
LA REAZIONE IN QUESTIONE È CAO + H2O → CA(OH)2
QUINDI LA RISPOSTA CORRETTA È C
2. UN METODO PER OTTENERE CROMO METALLICO SFRUTTA LA SEGUENTE REAZIONE (DA BILANCIARE): AL + CR2 O3 → AL2 O3 + CR
STABILIRE QUANTE MOLI DI CR SI FORMANO MESCOLANDO 10 MOLI DI CR2 O3 CON 30 MOLI DI AL.
A) 10
B) 20
D) 40 C) 30
SOLUZIONE
LA REAZIONE BILANCIATA È 2 AL + CR2O3 → AL2O3 + 2 CR
DA QUESTA VEDIAMO CHE DA 1 MOLE DICR2O3 SI OTTENGONO 2 MOLI DI CR QUINDI DA 10 MOLI SE NE OTTENGONO 20
LA RISPOSTA È C
3. LA COMPOSIZIONE CHIMICA DELLO SMERALDO È .BE3 A2L SI6 O18 . CALCOLARE LA COMPOSIZIONE PERCENTUALE DELLO
SMERALDO.
A) BE 5,03%; AL 10,04%; SI 31,35%; O 53,58%
B) BE 5,03%; AL 10,04%; SI 53,58%; O 31,35%
C) BE 5,03%; AL 5,04%; SI 31,35%; O 58,58%
D) BE 25,03%; AL 30,04%; SI 29,35%; O 15,58%
3. SOLUZIONE
LE MASSE ATOMICHE SONO: BE (9,01 U); AL (27 U); SI (28,09 U); O (16 U) PERTANTO IL PM DELLO SMERALDO È:
3 ∙X 9,01 + 2 X 27 + 6 X 28,09 + 18 X 16 = 537,57 U.
SE IN 537,5 VI SONO 90,01 X 3 IN 100 VE NE SONO X X= % BE = 5,03
SE IN 537,5 VI SONO 2 X 27 IN 100 VE NE SONO X X= % AL = 10,04
SE IN 537,5 VI SONO 6 X 28,09 IN 100 VE NE SONO X X= % SI = 31,35
SE IN 537,5 VI SONO18 X 16 IN 100 VE NE SONO X X= % O = 53,57
LA COMPOSIZIONE % M/M È:
BE 5,03%; AL 10,04%; SI 31,35%; O 53,57%.
RISPOSTA CORRETTA A
4. CHE COLORE ASSUME LA CARTINA INDICATRICE UNIVERSALE A PH= 4?
A) ROSSO
B) GIALLO
C ARANCIONE
D) VERDE
SOLUZIONE
A PH= 14 LA CARTINA È BLU, A PH= 0 È ROSSA, A PH= 4 È ARANCIONE.
RISPOSTA CORRETTA C
5. INDICARE QUALE PEZZO DI VETRERIA DI LABORATORIO NON ESISTE.
A) PIPETTA TARATA
B) MATRACCIO GRADUATO
C) CILINDRO GRADUATO
D) BURETTA GRADUATA
SOLUZIONE
GRANDI VOLUMI DI SOLUZIONE SI MISURANO COL MATRACCIO CHE HA UNA SOLA TACCA PER INDICARE IL VOLUME E NON HA ALTRE TACCHE PER CUI NON È UN PEZZO DI VETRERIA GRADUATO.
RISPOSTA CORRETTA B
6. LA P NELL’ACRONIMO DPI, DOVE D = DISPOSITIVO ED I = INDIVIDUALE, STA PER:
A) PROTEZIONE B) PREVENZIONE C) PREPARAZIONE D) PRODUZIONE
6. SOLUZIONE
I DPI SONO UTILIZZATI PER PROTEGGERE I LAVORATORI IN GENERALE, E IN CHIMICA VE NE SONO DIVERSI AD ES. GUANTI,OCCHIALI ,CAMICI E QUANT’ALTRO NECESSARIO QUINDI DPI SIGNIFICA DISPOSITIVO DI PROTEZIONE INDIVIDUALE .
RISPOSTA CORRETTA A
7. INDICA QUALE TRA I SEGUENTI METALLI HA IL PUNTO DI FUSIONE PIÙ BASSO:
A) GA
B) PT
C) AU
D) HG
SOLUZIONE
TRA QUESTI METALLI ,IL SOLO A TROVARSI ALLO STATO LIQUIDO A TEMPERATURA AMBIENTE È IL MERCURIO PER CUI LA RISPOSTA CORRETTA È D
8. NELLA REAZIONE DI ELETTROLISI DELL’ACQUA, CHE DÀ IDROGENO E OSSIGENO MOLECOLARI, QUANTE MOLI DI OSSIGENO SI SVILUPPANO PER OGNI MOLE DI IDROGENO PRODOTTO?
A) 0,5
B) 1
C) 2
D) 4
SOLUZIONE
LA REAZIONE DI ELETTROLISI È 2 H2O → 2 H2 + O2
DA QUESTA SI EVINCE CHE DA OGNI MOLE DI H2 SI OTTIENE METÀ MOLE DI OSSIGENO QUINDI DA 1 MOLE D H2O SI FORMANO 0.5 MOLI DI O
RISPOSTA CORRETTA A
9. L’ELETTRONEUTRALITÀ DELL’ATOMO DI UN ELEMENTO CHIMICO È DATA DA:
A) UGUAL NUMERO DI NEUTRONI E PROTONI
B) UGUAL NUMERO DI ELETTRONI E NEUTRONI
C) UGUAL NUMERO DI ELETTRONI E NUCLEONI
D) UGUAL NUMERO DI ELETTRONI E PROTONI
SOLUZIONE
L’ELETTRONEUTRALITÀ DI UN ATOMO SI HA QUANDO LE CARICHE POSITIVE DEI PROTONI PRESENTI NEL NUCLEO SONO UGUALI A QUELLE
NEGATIVE DEGLI ELETTRONI
RISPOSTA CORRETTA D
10. UNA TRASFORMAZIONE CHIMICA SI DICE ESOTERMICA QUANDO:
A) IL SISTEMA ACQUISTA CALORE DALL’AMBIENTE
B) IL SISTEMA CEDE CALORE ALL’AMBIENTE
C) SISTEMA E AMBIENTE CEDONO CALORE
D) SISTEMA E AMBIENTE ACQUISTANO CALORE
SOLUZIONE
UNA TRASFORMAZIONE CHIMICA È ESOTERMICA QUANDO CEDE CALORE ALL’AMBIENTE
IN UNA REAZIONE CHIMICA LA SOMMA ∑ DELLE ENTALPIE (L’ENTALPIA SI INDICA CON H ) DEI PRODOTTI MENO LA SOMMA ∑ DELLE ENTALPIE DEI REAGENTI PUÒ ESSERE :
∑ H PRODOTTI – ∑ H REAGENTI
-MAGGIORE DI ZERO ( REAZIONE ENDOTERMICA CHE VUOL DIRE CHE LE ENTALPIE DEI PRODOTTI SONO MAGGIORI DELLE ENTALPIE DEI REAGENTI PER CUI LA REAZIONE NECESSITA DI CALORE FORNITO DALL’ESTERNO)
– MINORE DI ZERO ( REAZIONE ESOTERMICA CHE VUOL DIRE CHE LE ENTALPIE DEI PRODOTTI SONO MINORI DELLE ENTALPIE DEI REAGENTI PER CUI LA REAZIONE PRODUCE CALORE )
–UGUALE A ZERO (LA REAZIONE È IN EQUILIBRIO TERMICO)
RISPOSTA CORRETTA B
11. NELLA MOLECOLA HF È PRESENTE UN LEGAME:
A) COVALENTE PURO B) COVALENTE POLARE C) IONICO D) METALLICO
SOLUZIONE
L FLUORURO DI IDROGENO, HF, È UN GAS INCOLORE, VELENOSO, ALTAMENTE TOSSICO, CORROSIVO, NON INFIAMMABILE E LIQUEFATTO, CON UN ODORE PUNGENTE E IRRITANTE.

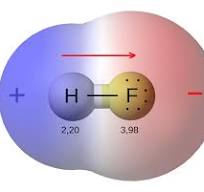
H——-F
IL LEGAME TRA L’H E F È DOVUTO ALLA SOVRAPPOSIZIONE DEGLI ORBITALI 1S DELL’IDROGENO E 2PZ DEL FLUORO OGNUNO DEI QUALI CONTRIBUISCE AL LEGAME CON 1 ELETTRONE
1S2 2S2 2PX2 2PY2 2PZ1
↓ ↓
1S1
SI FORMA QUINDI UN LEGAME COVALENTE (INFATTI SI METTONO IN COMUNE I 2 ELETTRONI CON LA SOVRAPPOSIZIONE DEI 2 ORBITALI). TUTTAVIA, IL F HA ELETTRONEGATIVITÀ DI 3,98 NELLA SCALA DI PAULING MENTRE L’H HA ELETTRONEGATIVITÀ 2,20 PER CUI LA NUVOLA ELETTRONICA DEL LEGAME È SPOSTATA VERSO IL FLUORO CHE ATTRAE DI PIÙ GLI ELETTRONI.(VEDI LA FIGURA)
SI DEDUCE CHE IL FLUORO ASSUME UNA PARZIALE CARICA NEGATIVA MENTRE L’H ASSUME UNA CARICA PARZIALE POSITIVA. SI CREA PERTANTO UN DIPOLO Δ+ SULL’H E Δ- SU F
IL LEGAME È QUINDI UN LEGAME COVALENTE POLARE
RISPOSTA CORRETTA B
12. IL PUNTO DI EBOLLIZIONE DELL’IDROGENO MOLECOLARE H2 È PIÙ BASSO DI QUELLO DELL’AMMONIACA, NH3, PERCHÉ:
A) NELL’AMMONIACA LE FORZE INTERMOLECOLARI SONO PIÙ FORTI DI QUELLE PRESENTI TRA LE MOLECOLE DI IDROGENO
B) NELL’AMMONIACA LE FORZE INTERMOLECOLARI SONO PIÙ DEBOLI DI QUELLE PRESENTI TRA LE MOLECOLE DI IDROGENO
C) LA MOLECOLA DI AMMONIACA È PIÙ GRANDE DI QUELLA DELL’IDROGENO
D) LA MOLECOLA DI AMMONIACA È PIÙ PICCOLA DI QUELLA DELL’IDROGENO
12. SOLUZIONE
L’EBOLLIZIONE È IL PASSAGGIO DI UNA SOSTANZA DALLO STATO LIQUIDO ALLO STATO AERIFORME, IN CUI LE MOLECOLE A CAUSA DEL CALORE FORNITO AUMENTANO LA LORO ENERGIA CINETICA E= 1/2 MV2..
SI FORMANO QUINDI BOLLE GASSOSE LE QUALI, DILATANDOSI PER EFFETTO TERMICO, SALGONO IN SUPERFICIE E LIBERANO IL VAPORE IN ESSE CONTENUTO. QUESTO FENOMENO, CONTRARIAMENTE ALL’EVAPORAZIONE, AVVIENE A UNA TEMPERATURA BEN PRECISA PER OGNI SOSTANZA (DETTA TEMPERATURA DI EBOLLIZIONE. ).
SE PERÒ NEL LIQUIDO LE MOLECOLE SUBISCONO ATTRAZIONI DOVUTE A LEGAMI IDROGENO O DI ALTRO TIPO, LA TEMPERATURA DI EBOLLIZIONE AUMENTA PERCHÈ I LEGAMI DI QUEL TIPO SI DEVONO SPEZZARE CONSUMANDO ENERGIA. NEL CASO IN ESAME ESSENDO NH3 POLARE PRESENTA ALLO STATO LIQUIDO FORZE INTERMOLECOLARI PIÙ FORTI DI QUELLE DELL’ H ESSENDO QUESTI UNA MOLECOLA APOLARE, INOLTRE NH3 HA UNA MASSA M MAGGIORE RISPETTO ALL’IDROGENO E DEVE ACQUISTARE PIÙ CALORE PER AVERE UN’ENERGIA CINETICA MAGGIORE PER PASSARE ALLA FASE GASSOSA COME SI È VISTO E=1/2 MV2
RISPOSTA CORRETTA A + B
13. INDICARE QUALE DELLE SEGUENTI COPPIE DI ELEMENTI PUÒ REALIZZARE UN LEGAME COVALENTE:
A) NA I
B) N O
C) F Ca
D) Br K
SOLUZIONE
TRA GLI ALOGENI (MOLTO ELETTRONEGATIVI) E I METALLI ALCALINI O ALCALINO-TERROSI (POCO ELETTRONEGATIVI) CHE SI TROVANO AGLI OPPOSTI NELLA TAVOLA DEGLI ELEMENTI SI FORMANO LEGAMI IONICI E QUINDI GLI ELEMENTI IN A C D FORMANO COMPOSTI IONICI, INVECE TRA AZOTO E OSSIGENO, CHE SI TROVANO NELLA ZONA CENTRALE DELLA TAVOLA PERIODICA SI FORMANO LEGAMI COVALENTI ANCHE SE NON AL 100% IN QUANTO L’OSSIGENO ATTIRA DI PIÙ GLI ELETTRONI DEL LEGAME.
RISPOSTA CORRETTA B
14. LO IODIO I2 È SOLUBILE IN TETRACLORURO DI CARBONIO, CCL4 , PERCHÉ:
A) ENTRAMBI I COMPOSTI SONO APOLARI
B) ENTRAMBI I COMPOSTI SONO POLARI
C) IL PRIMO COMPOSTO È POLARE MENTRE IL SECONDO NO
D) LO IODIO NON È SOLUBILE IN TETRACLORURO DI CARBONIO
14. SOLUZIONE
SIA LO IODIO I2 CHE CCL4 SONO MOLECOLE APOLARI E QUINDI I2 SI SCIOGLIE IN CCL4.
SOSTANZE POLARI SI SCIOLGONO IN SOLVENTI POLARI
SOSTANZE APOLARI SI SCIOLGONO IN SOLVENTI APOLARI
SIMILES SIMILIA DISSOLVUNT
RISPOSTA CORRETTA A
15. QUALE DELLE SEGUENTI COPPIE HA LA STESSA CARICA E CIRCA LA STESSA MASSA?
A) UN ELETTRONE E UN PROTONE
B) UN PROTONE E UN NEUTRONE
C) UN NEUTRONE E UN ATOMO DI IDROGENO
D) UN ATOMO DI IDROGENO E UN PROTONE
15. SOLUZIONE
PROTONI E NEUTRONI SONO FORMATI DA PARTICELLE ELEMENTARI PIÙ PICCOLE CHIAMATE QUARKS.
IL PROTONE È FORMATO DA 2 QUARKS UP ED 1 QUARK DOWN
IL NEUTRONE È FORMATO DA 2 QUARKS DOWN ED 1 QUARK UP
OGNI QUARK “UP” HA UNA CARICA PARI A 2/3 DELLA CARICA DI UN ELETTRONE
OGNI QUARK “DOWN”HA UNA CARICA PARI A -1/3 DELLA CARICA DI UN ELETTRONE.
DUE QUARK UP ED UN QUARK DOWN FORMANO UN PROTONE (CARICA: 2/3 + 2/3 -1/3 = 3/3= +1),
DUE QUARK DOWN ED UN QUARK UP FORMANO UN NEUTRONE (CARICA:-1/3+ -1/3 + 2/3 = -2/3 +2/3= 0).
UN NEUTRONE QUINDI E’ NEUTRO ED HA UNA MASSA UGUALE A QUELLA DI UN PROTONE
L’IDROGENO È COSTITUITO DA 1 PROTONE + 1 ELETTRONE
LA MASSA DELL’ELETTRONE E’ MOLTO PICCOLA RISPETTO ALLA MASSA DEL PROTONE O DEL NEUTRONE
SI DEDUCE CHE LA MASSA DEL NEUTRONE E’ CIRCA QUELLA DI UN ATOMO DI IDROGENO (LA MASSA DELL’ ELETTRONE E’ TRASCURABILE) E SONO AMBEDUE NEUTRI ELETTRICAMENTE –
RISPOSTA CORRETTA C
16. NELL’ACQUA DI MARE SONO PRESENTI DIVERSI METALLI. L’ORO (MM 197 G/MOL) È UNO DI QUESTI, ED È PRESENTE IN QUANTITÀ PARI A 0,15 MG/TONNELLATA. APPROSSIMANDO LA DENSITÀ DELL’ACQUA DI MARE A 1,0 G/ML, QUANTI ATOMI DI AU SI POTREBBERO ESTRARRE DAL 250 L DI ACQUA DI MARE?
A) 1,15 ∙1014
B) 1,15 ∙104
C) 1,15 ∙1017
D) 1,15 ∙10‒17
16. SOLUZIONE
0,15 MG OGNI 1000 LITRI DI ACQUA
250 LITRI CONTENGONO X MG AU
1000 :0,15 =250 :X
X= 0,0375 MG CIOÈ 3,75 ∙10‒5 G DI ORO ED ESSENDO LA MA DELL’ORO PARI A 197
3,75 ∙10‒5 G / 197 =1,904 ∙10‒7 MOLI DI AU IN 250 LITRI DI ACQUA DI MARE
PER CONOSCERE IL NUMERO DI ATOMI CONTENUTI IN QUESTA QUANTITÀ RICORDIAMO CHE
IN 1 MOLE DI UNA QUALUNQUE SOSTANZA VI SONO 6,02 X 1023ATOMI QUINDI
1 MOLE : 6,02 X 1023ATOMI = 1,904 ∙10‒7 MOLI : X
X = N. ATOMI IN 250 LITRI DI ACQUA DI MARE = 6,02 X 1023 X 1,904 ∙10‒7 /1 = 1,15 ∙1017 ATOMI.
RISPOSTA CORRETTA C
17. DIAMANTE E GRAFITE SONO DUE FORME ALLOTROPICHE DEL CARBONIO. SCEGLIERE L’AFFERMAZIONE CORRETTA.
A) IL DIAMANTE È UN CONDUTTORE ELETTRICO
B) IL DIAMANTE È PIÙ DENSO DELLA GRAFITE
C) LA GRAFITE HA DENSITÀ MAGGIORE DEL DIAMANTE
D) LA GRAFITE È UN ISOLANTE ELETTRICO
17. SOLUZIONE
LE STRUTTURE DI GRAFITE E DIAMANTE SONO MOSTRATE IN FIGURA
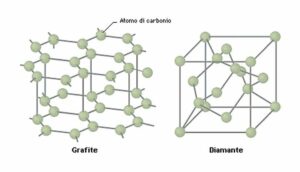
LA GRAFITE, HA UNA STRUTTURA RETICOLARE A FOGLI CIOÈ A PIANI PARALLELI FACILMENTE SEPARABILI, COSTITUITI DA ANELLI DI C ESAGONALI (BENZENICI) ED OGNI ATOMO DI CARBONIO È LEGATO AD ALTRI TRE CON LEGAMI COVALENTI DISPOSTI A 120° QUINDI CON IBRIDI SP2 CHE FORMANO LEGAMI SIGMA E LEGAMI Π CHE CONFERISCONO GRANDE MOBILITÀ AGLI ELETTRONI QUINDI LA GRAFITE È UN OTTIMO CONDUTTORE DI ELETTRICITÀ. I PIANI RETICOLARI SONO TENUTI INSIEME DA LEGAMI DI VAN DER WAALS E FORZE DI LONDON PER CUI LA GRAFITE A CAUSA DELLA STRUTTURA È MENO DENSA DEL DIAMANTE.
IL DIAMANTE HA UNA STRUTTURA RETICOLARE A TRIDIMENSIONALE IN CUI UN ATOMO DI CARBONIO È LEGATO CON LEGAMI COVALENTI SP3 AD ALTRI 4 ATOMI CHE LO CIRCONDANO SU TRE DIMENSIONI ; TALE STRUTTURA GLI CONFERISCE UNA MAGGIORE DENSITÀ RISPETTO ALLA GRAFITE E LA DUREZZA DEL DIAMANTE È PERTANTO NOTEVOLMENTE SUPERIORE A QUELLA DELLA GRAFITE CHE INVECE È SFALDABILE FACILMENTE LUNGO I PIANI.
RISPOSTA CORRETTA B
18. QUALE DELLE SEGUENTI MOLECOLE HA MOMENTO DI DIPOLO NULLO?
A) NO2
B) F2
C) HF
D) SF4
SOLUZIONE

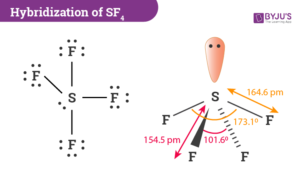
CONSIDERATE LE STRUTTURE IN ESAME, SI OSSERVA CHE L’UNICA MOLECOLA NON POLARE È F2 CHE FORMA UN LEGAME COVALENTE APOLARE-
RISPOSTA CORRETTA B
19. INDICARE IL NOME IUPAC DEL NITRITO DI SODIO:
A) DIOSSONITRATO DI SODIO B) MONOSSINITRITO DI SODIO
C) TRIOSSONITRATO DI SODIO
D) NESSUNA DELLE RISPOSTE È CORRETTA
SOLUZIONE
ESSENDO PRESENTI DUE ATOMI DI O IL PRIMO TERMINE DEL NOME È DIOSSO
POICHÈ L’ATOMO CENTRALE È L’AZOTO IL SECONDO TERMINE È NITRATO
IL NOME COMPLETO È DIOSSONITRATO DI SODIO
RISPOSTA CORRETTA A
20. L’ACETO COMMERCIALE È UNA SOLUZIONE AL 5,0% M/M DI ACIDO ACETICO CH3COOH (MM = 60,0 G/MOL). QUAL È LA
MOLARITÀ DELL’ACIDO ACETICO NELL’ACETO? (D ACETO = 1,00 G/ML)
A) 1,67 MOL/L
B) 0,83 MOL/L
C) 1,00 MOL/L
D) 3,00 MOL/L
20. SOLUZIONE
LA SOLUZIONE COMMERCIALE CONTIENE 5 G DI CH3COOH IN 100 G DI SOLVENTE CIOÈ 50 G IN 1 KG ESSENDO D= 1 G/ML
ESSENDO LA MOLARITÀ = G/PM AVREMO
M= 50 G / 60 G = 0,83 MOL/L
RISPOSTA CORRETTA B
.21. INDICARE TRA I SEGUENTI ACIDI L’ACIDO TRIOSSOFOSFORICO(V):
A) H3PO3
B) HPO3
C) H3PO4
D) H4P2O7
21. SOLUZIONE
RICORDIAMO CHE LA DESINENZA ICO SI ATTRIBUISCE QUANDO L’ATOMO CENTRALE HA IL MASSIMO NUMERO DI OSSIDAZIONE, QUINDI IN QUESTO CASO IL P DEVE AVERE N.O= + 5
INOLTRE IL TERMINE TRIOSSO CI DICE CHE VI DEVONO ESSERE 3 ATOMI DI O
NELL’ESERCIZIO PROPOSTO I 3 ATOMI DI O LI TROVIAMO IN H3PO3 ED HPO3 MA I N.O SONO
H3PO3 N.O. = 3 X 2 -3 = +3
HPO3 N.O. = 3 X 2 – 1 = +5
SI DEDUCE QUINDI CHE L’ACIDO TRIOSSO FOSFORICO È HPO3
RISPOSTA CORRETTA B
22. INDICARE IL VOLUME AL QUALE BISOGNA DILUIRE 10 ML DI UNA SOLUZIONE ACQUOSA DI HCLO 2,0 MOL/L PER OTTENERE
UNA SOLUZIONE DI HCLO 4 MOL/L.
A) 100 ML
B) 75 ML
C) 50 ML
D) 25 ML
22. SOLUZIONE
FACENDO IL CALCOLO SECONDO IL METODO DELLA CROCE SI HA
2 → 0, 4
0, 4
0 (H2O) → 1,6
QUINDI OGNI 0,4 PARTI DI ACIDO AL 2 M/L SI USANO 1,6 PARTI DI H2O
QUINDI 0,4 : 1,6 = 10 : X X= 40 PARTI DI H2O
IL VOLUME FINALE SARÀ QUINDI 10 + 40 H2O = 50 ML DI SOLUZIONE
RISPOSTA CORRETTA C
23. QUANTO HCL AL 20% IN PESO (MM = 36,46 G/MOL) È NECESSARIO PER FAR REAGIRE 100 G DI CACO3 (MM = 100,09 G/MOL) SECONDO L’EQUAZIONE NON BILANCIATA?
CACO3 (S) + HCL (AQ) → CACL2 (AQ) + CO2 (G) + H2O (L)
A) 36,50 G
B) 182,5 G
C) 365,0 G
D) 730,0 G
23. SOLUZIONE
LA REAZIONE BILANCIATA È : CACO3 + 2 HCL → CACL2 + CO2 + H2O
SE 100,09 G DI CACO3 REAGISCONO CON 2 X 36,46 DI HCL CIOÈ 100 G DI CACO3 REAGISCONO CON 72,92 G HCL
CIÒ SAREBBE CORRETTO SE L’HCL USATO FOSSE AL 100% INVECE L’HCL CHE USIAMO È AL 20 % QUINDI
SE PRENDENDO 100 G DI HCL IN REALTÀ NE PRELEVO 20 G DEVO PRELEVARE X G PER AVERE 72,92 G CHE NECESSITANO NELLA REAZIONE
100: 20 = X: 72,92 X = 72,92 X 100 / 20 = 364,6 G CHE ARROTONDATO È 365,0 G
RISPOSTA CORRETTA C
24. IL BROMO MOLECOLARE GASSOSO E LO IODIO MOLECOLARE GASSOSO SONO COINVOLTI, AD ALTA TEMPERATURA, IN UN EQUILIBRIO CHIMICO IN FASE GASSOSA SECONDO LA REAZIONE:
BR2 +I2 ⇔ 2 BRI
SAPENDO CHE UNA MISCELA DEI TRE GAS HA FRAZIONI MOLARI 0,1, 0,2 E 0,4 E CHE LA COSTANTE DI EQUILIBRIO È K EQ= 13 A 1200 K, SI PUÒ AFFERMARE CHE:
A) IL SISTEMA È ALL’EQUILIBRIO
B) IL SISTEMA EVOLVERÀ VERSO I REAGENTI FINO AL RAGGIUNGIMENTO DELL’EQUILIBRIO
C) IL SISTEMA EVOLVERÀ VERSO I PRODOTTI FINO AL RAGGIUNGIMENTO DELL’EQUILIBRIO
D) I DATI FORNITI NON CONSENTONO UNA PREVISIONE RIGUARDANTE LA COMPOSIZIONE ALL’EQUILIBRIO DEL SISTEMA
24. SOLUZIONE
SAPENDO CHE LE CONCENTRAZIONI IN QUESTO ESEMPIO SI ESPRIMONO IN FRAZIONE MOLARE X PRESSIONE TOTALE POSSIAMO SCRIVERE
(0,4X P)2/ 0,1 P X 0,2 P = KR=8 ( IL TERMINE P SI SEMPLIFICA)
IL VALORE RISULTANTE KR= 8 È È MINORE DI KEQ =13 QUINDI PERCHÈ IL RAPPORTO ARRIVI ALL’EQUILIBRIO CIOÈ RAGGIUNGA IL VALORE DI 13, IL NUMERATORE DEVE AUMENTARE E CIÒ SIGNIFICA CHE LA REAZIONE NECESSARIAMENTE EVOLVE VERSO DESTRA PER FORMARE UNA MAGGIORE QUANTITÀ DI BRI SINO A CHE KR =13
RISPOSTA CORRETTA C
25. IN QUALE DELLE SEGUENTI MOLECOLE PREVEDETE CHE IL LEGAME O-O (OSSIGENO-OSSIGENO) SIA PIÙ CORTO?
A) H2 O2 B) O 2
C) O 3
D) NELLE TRE MOLECOLE HA LA STESSA LUNGHEZZA
SOLUZIONE
LA LUNGHEZZA DI LEGAME (O DISTANZA DI LEGAME) RAPPRESENTA LA DISTANZA TRA I NUCLEI DI DUE ATOMI UNITI TRA LORO.
TRA LE PRINCIPALI CARATTERISTICHE SI POSSONO ELENCARE LE SEGUENTI:
- QUANTI PIÙ ELETTRONI PARTECIPANO ALLA FORMAZIONE DEL LEGAME , MINORE SARÀ LA LUNGHEZZA DI LEGAME;
- AL DIMINUIRE DELLA DISTANZA DI LEGAME, AUMENTANO L’ENERGIA DEL LEGAME E LE FORZE ATTRATTIVE FRA GLI ATOMI;
- DIPENDE DALL’ IBRIDAZIONE MOLECOLARE E DALLA NATURA ELETTRONICA E STERICA DEI SOSTITUENTI;
- PER LA STESSA COPPIA DI ATOMI, IL LEGAME TRIPLO È PIÙ CORTO DEL LEGAME DOPPIO IL QUALE È PIÙ CORTO DEL LEGAME SEMPLICE
- IN UN LEGAME COVALENTE OMOPOLARE LA METÀ DELLA DISTANZA DI LEGAME È UGUALE AL RAGGIO COVALENTE
LA DISTANZA DI LEGAME DIMINUISCE ALL’AUMENTARE DELL’ORDINE DI LEGAME.
L’ORDINE DI LEGAME È UN INDICE DELLA FORZA DEL LEGAME CHIMICO TRA DUE ATOMI, ED È DEFINITO COME LA SEMIDIFFERENZA TRA IL NUMERO DI ELETTRONI LEGANTI E IL NUMERO DI ELETTRONI ANTILEGANTI.
ORDINE DI LEGAME = 1/2 (NUMERO ELETTRONI LEGANTI E NUMERO ELETTRONI ANTILEGANTI.
SE L’ORDINE DI LEGAME AUMENTA SIGNIFICA CHE IL NUMERO DI ELETTRONI LEGANTI È SUPERIORE AL NUMERO DI ELETTRONI ANTILEGANTI E QUESTO SIGNIFICA CHE IL LEGAME HA UN’ENERGIA MAGGIORE E QUINDI È PIÙ CORTO IN LUNGHEZZA.
PER CALCOLARE QUANTI ELETTRONI DI LEGAME E DI ANTILEGAME VI SONO,RAPPRESENTIAMO GRAFICAMENTE LE ENERGIE DEGLI ORBITALI SIA DEGLI ATOMI SINGOLI SIA DI QUELLI DELLA MOLECOLA. PRENDIAMO AD ES. LA MOLECOLA DI O2
OGNI ATOMO DI OSSIGENO POSSIEDE 8 ELETTRONI NELLA STRUTTURA 1S2 2S2 2PX2 2PY1 2PZ1
QUANDO SI FORMA LA MOLECOLA DI O2 SI FORMANO GLI ORBITALI DI LEGAME CON ENERGIA PIÙ BASSA RISPETTO ALL’ENERGIA DEGLI ORBITALI DEI SINGOLI ATOMI E ORBITALI DI ANTILEGAME CHE POSSIEDONO ENERGIA PIÙ ALTA DEGLI ORBITALI DEI SINGOLI LEGAMI.
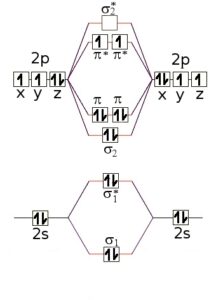
NELLA FIGURA I QUADRATINI A DESTRA E SINISTRA RAPPRESENTANO L’ENERGIA DEGLI GLI ORBITALI ATOMICI DEI 2 ATOMI DI OSSIGENO E QUELLI AL CENTRO L’ENERGIA DEGLI ORBITALI DELLA MOLECOLA(ORBITALI MOLECOLARI)
GLI ELETTRONI RIEMPIONO GLI ORBITALI DI LEGAME E QUELLI DI ANTILEGAME DELLA MOLECOLA SEGUENDO LA SOLITA REGOLA DEL RIEMPIMENTO DEI SINGOLI ORBITALI CIOÈ DUE ELETTRONI PER OGNI ORBITALE. IN QUESTO CASO PUOI VEDERE CHE I 16 ELETTRONI ( 8 PER OGNI ATOMO DI OSSIGENO) RIEMPIONO PRIMA GLI ORBITALI DI LEGAME E SUCCESSIVAMENTE QUELLI DI ANTILEGAME .
TI RAMMENTO CHE NELLA MOLECOLA DI O2 SI FORMANO SIA LEGAMI SIGMA CHE LEGAMI PI GRECO. I LEGAMI SIGMA DI LEGAME SONO PIÙ FORTI DI QUELLI PI GRECO ED HANNO ENERGIA PIÙ BASSA QUINDI SI RIEMPIONO PRIMA
INVECE I LEGAMI SIGMA DI ANTILEGAME HANNO ENERGIA PIÙ ALTA DEI LEGAMI PI GRECO DI ANTILEGAME PER CUI QUESTI ULTIMI SI RIEMPIONO PRIMA
SE CONTIAMO IL NUMERO DEGLI ELETTRONI DI LEGAME VEDIAMO CHE SONO 10 MENTRE QUELLI DI ANTILEGAME SONO 6
L’ORDINE DI LEGAME DELL’O2 = 1/2 (10 – 6) = 2
CONSIDERIAMO LA MOLECOLA DI OZONO IN QUESTA MOLECOLA L’ORDINE DI LEGAME È 1,5.

NELL’ACQUA OSSIGENATA H2O2 I DUE ATOMI DI OSSIGENO LEGANO UN IDROGENO CIASCUNO UTILIZZANDO GLI ELETTRONI PI GRECO E LA DIFFERENZA TRA ELETTRONI DI LEGAME ED ANTILEGAME È 2 PER CUI L’ORDINE DI LEGAME È 2/2=1
PERTANTO SI HA
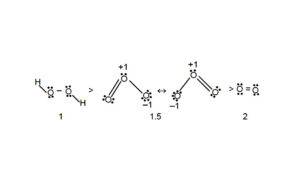
CONSIDERANDO QUINDI GLI ORDINI DI LEGAME DELLE TRE MOLECOLE , VEDIAMO CHE IL LEGAME PIÙ LUNGO È QUELLO TRA I DUE ATOMI DI OSSIGENO NELLA MOLECOLA H2O2 (O.LEG. 1 ) ED IL PIÙ CORTO È TRA I 2 ATOMI DI OSSIGENO NELLA MOLECOLA DI O2( ORD.LEG. 2)
RISPOSTA CORRETTA B
26. LA DENSITÀ DELL’ACQUA A 20 °C È DI 0,9982 G/ML. QUALE VALORE ESPRIME CORRETTAMENTE LA DENSITÀ DELL’ACQUA A 20 °C ESPRESSA IN KG/M3 ?
A) 0,9982 B) 0,9982 ∙10‒3 C) 998,2
D) 998,2 ∙103
SOLUZIONE
1 g=10‒3 Kg PER CUI 0,9982 g =0,998G2 X 10-3 Kg
1 ml =10‒6 m3
PERTANTO
LA DENSITÀ A 20 ° = 0,9982 X 10-3 Kg / 10-6 m3 = 0,9982 103 Kg/m3
d= 998,2 Kg/m3
RISPOSTA CORRETTA C
27. IMMAGINANDO DI FAR AVVENIRE LA COMBUSTIONE COMPLETA DI 1,0 g DEI SEGUENTI COMPOSTI: CH4, C3H6 , C6H14, C8H18, STABILIRE QUALE GENERA LA MAGGIOR QUANTITÀ DI CO2 .
A) CH4
B) C3H6
C) C6H14
D) C8H18
SOLUZIONE
LE REAZIONI DI COMBUSTIONE SONO :
CH4 + O2 → CO2 + H2O
2C3H6 + 9 O2 → 6 CO2 +6 H2O
2C6H14 + 19 O2 → 12 CO2 +14 H2O
2C8H18 +34 O2 → 16CO2 + 36 H2O
per il CH4 se da 16 g si ottengono 44 g di CO2 da 1 g sene ottengono X X= 44/16= 2,75 g CO2
per C3H6 se da 2 x 42,1 g si ottengono 6 x 44 g CO2 da 1 g se ne ottengono X X= 6×44/74,1 = 3,5 g CO2
per C6H14 se da 2 x 86,2 g si ottengono 12 x 44 g di CO2 da 1 g se ne ottengono X X= 172,4 / 558 =0,31 g CO2
per C8H18 se da 2 x 114,23 g si ottengono 16 x 44 g di CO2 da 1 g se ne ottengono X X= 704 / 228,44 = 3,0 CO2
dai dati ottenuti vediamo che la maggior quantità di CO2 viene prodotta da 1 g di C3H6 (3,5 g )
risposta corretta B
28. IN UN CAMPIONE DI H GASSOSO AD 1 ATM E A 298 K:
STABILIRE SE QUESTE AFFERMAZIONI SONO CORRETTE.
1. TUTTE LE MOLECOLE DI H SI MUOVONO ALLA STESSA VELOCITÀ;
2. LE MOLECOLE DI H COLLIDONO CON LE PARETI DEL RECIPIENTE CON UNA FREQUENZA MAGGIORE RISPETTO A QUELLA CHE SI
AVREBBE A 398 K.
.
A) NESSUNA DELLE DUE AFFERMAZIONI È CORRETTA
B) È CORRETTA SOLO L’AFFERMAZIONE 1
C) È CORRETTA SOLO L’AFFERMAZIONE 2
D) SONO CORRETTE ENTRAMBE LE AFFERMAZIONI
. SOLUZIONE
In un gas, l’energia cinetica delle molecole è Ec = 1/2 m v2
le molecole tuttavia, secondo Boltzman possiedono velocità diverse secondo la seguente distribuzione
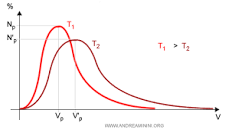
Se la temperatura aumenta, la curva si sposta in alto a destra, si allunga e il picco si abbassa.
in base a questa distribuzione LA PRIMA DEFINIZIONE È ERRATA in quanto secondo Boltzman le molecole hanno diversa velocità
Essendo la pressione di un gas determinata dal numero di urti con le pareti e poichè sappiamo che PV=nRT è chiaro che all’aumentare della temperatura T , aumenta anche la pressione P cioè il numero degli urti sulle pareti del recipiente poichè all’aumentare della temperatura l’energia cinetica media delle molecole aumenta proporzionalmente secondo la formula
Ec = 3/2 Kb T
dove Kb = costante di Boltzman = 1,380 6503(24) × 10 –23
Kb= 8,314 / 6,02 x 1023
cioè Kb= costante universale dei gas / costante di Avogadro= R/N
da quanto detto è evidente che a 298 K l’energia cinetica media delle molecole è inferiore all’energia cinetica media che si ha a 398 K questo significa che anche la risposta 2 è errata
risposta corretta A
29. PER LA MOLECOLA CH3NNCH3 STABILIRE QUALE GEOMETRIA ASSUMONO L’ATOMO DI CARBONIO E QUELLO DI AZOTO.
A) TETRAEDRICA PER C E LINEARE PER N
B) TETRAEDRICA PER C E ANGOLATA PER N
C) ANGOLATA PER C E ANGOLATA PER N
D) ANGOLATA PER C E LINEARE PER N
29. SOLUZIONE
il composto è il 1,2-dimethildiazene che può assumere le due strutture forma CIS e forma TRANS
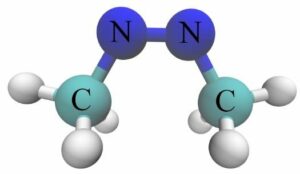
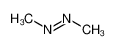
essendo presente un doppio legame tra i due atomi di azoto, questi utilizza legami ibridi SP2 che formano un angolo di 120° gli atomi di carbonio in CH3 hanno invece struttura tetraedrica perchè il C utilizza ibridi SP3
si deduce che la risposta corretta è B
30. INDICARE LA MOLECOLA CHE HA UN MOMENTO DIPOLARE PERMANENTE.
A) CF4 B) C2F4
C) SF 4
D) SF6
LA GEOMETRIA MOLECOLARE indica se la molecola possiede o meno un momento dipolare
La molecola CF4 è tetraedrica e ha simmetria Td con l’atomo di carbonio centrale ibrido sp3.Il suo momento dipolare è di conseguenza nullo.

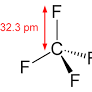
Il fluoro è l’elemento più elettronegativo tra tutti gli atomi e i legami C–F sono i più polari e la carica parziale sul carbonio di CF4 è stimata in +0,72 e.
la molecola C2F4

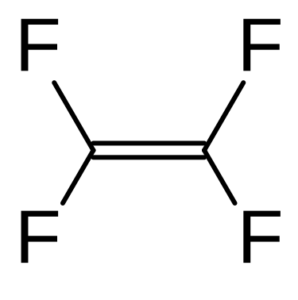
il Il tetrafluoroetene dà origine al Teflon essendo il monomero che polimerizza.
La molecola del tetrafluoroetilene è planare, gli atomi F sono legati al carbonio con legami semplici mentre i due atomi di C formano tra loro un doppio legame (σ + π) e sono ibridati sp2. La simmetria della molecola appartiene al gruppo D2h, e quindi il suo momento di dipolo è nullo.
la molecola SF4
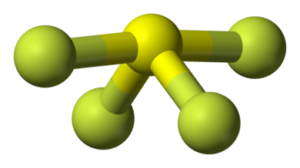
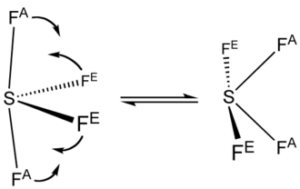
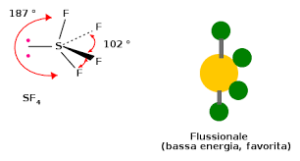
è del tipo AX4E e, usando i principi della teoria VESPR , si può prevedere che la molecola sia a forma di altalena, forma derivante dalla bipiramide trigonale con S al centro. La molecola ha simmetria C2v. La coppia di elettroni non condivisa occupa una posizione equatoriale nella virtuale bipiramide trigonale, insieme a due dei quattro atomi di fluoro, gli altri due sono nelle posizioni assiali. Conseguentemente, si hanno due diverse distanze di legame: per gli F assiali si ha S–Fax = 164,3 pm e per quelli equatoriali S–Feq= 154,2 pm. Come succede in genere, i leganti in posizione assiale sono legati più debolmente e quindi con legami più lunghi. La presenza di una coppia di non legame sullo zolfo causa un momento dipolare quindi la molecola è polare.
la molecola SF6
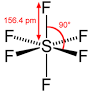
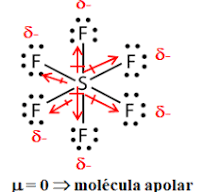
La molecola di SF6 ha una geometria ottaedrica ed ha momento dipolare nullo
RISPOSTA CORRETTA C
31. 1,00 L DI METANO (MISURATO A 120 °C E AD 1 ATM,) REAGISCE COMPLETAMENTE CON OSSIGENO; STABILIRE IL VOLUME DEI DUE PRODOTTI CHE SI OTTENGONO DALLA COMBUSTIONE, MISURATI NELLE STESSE CONDIZIONI DI TEMPERATURA E PRESSIONE. A) 2,00 L CO E 4,00 L H2 O B) 2,00 L CO 2 E 2,00 L H2 O
C) 1,00 L CO 2 E 4,00 L H2 O D) 1,00 L CO2 E 2,00 L H2 O
31. SOLUZIONE
LA REAZIONE È: CH4 + 2 O2 → CO2+ 2 H2 O
CONSIDERATO CHE TUTTO IL METANO FORMA CO2 DALLA LEGGE DEI GAS PV=nRT possiamo fare il ragionamento seguente:
dalla reazione scritta sopra si vede che da 1 mole di gas CH4 si ottiene 1 mole di CO2 quindi per ambedue i gas n=1
il volume calcolato per ambedue i gas sarà V=1 RT /P per ambedue i gas quindi il volume sarà uguale per i due gas essendo T e P uguali per CH4 e CO2
Per lo stesso ragionamento si ottiene il doppio per H2O.
Quindi otteniamo 1 litro di CO2 e 2 litri di H2O
risposta corretta D
32. 2,50 L DI BUTANO (C H ) GASSOSO, MISURATI A 22,0 ºC E A 1,20 ATM, REAGISCONO COMPLETAMENTE CON OSSIGENO.
STABILIRE IL VOLUME DI DIOSSIDO DI CARBONIO CHE SI OTTIENE, MISURATO NELLE STESSE CONDIZIONI DI T E P.
4 10
A) 22,5 L B) 10,0 L
C) 2,50 L
D) 9,00 L
32. SOLUZIONE
LA REAZIONE È: 2C4H10 + 26 O2 → 8CO2 + 10 H2O
sappiamo che nelle stesse condizioni di t e p, volumi uguali di gas contengono lo stesso numero di moli, se da 1 mole di C4H10 si ottengono 4 moli di CO2 da 2,5 moli se ne ottengono 2,5 x 4 = 10 moli
risposta corretta B
33. IL METANOLO È OTTENUTO INDUSTRIALMENTE PER IDROGENAZIONE CATALITICA DEL MONOSSIDO DI CARBONIO IN BASE ALLA SEGUENTE EQUAZIONE CHIMICA:
CO+ 2 H2 → CH3 OH
CALCOLARE IL VOLUME DI CO, MISURATO IN CONDIZIONI STANDARD, NECESSARIO PER PRODURRE 1,0 ∙106 Kg DI METANOLO, SAPENDO CHE LA REAZIONE PROCEDE CON UNA RESA DEL 40%.
A) 1,7 ∙10 L 9
B) 2,8 ∙10 L8
C) 7,0 ∙10 L8
D) 2,1 ∙10 L9
33. SOLUZIONE
106 Kg di metanolo corrispondono a 1,0 ∙106 /32 = 3,125 x109 moli essendo 32 il PM metanolo – dalla reazione vediamo che
se 1 mole di CO produce 1 mole di metanolo allora si useranno 3,125 x109moli di CO per produrre 3,125 x109moli di CH3OH
Questo se la resa della reazione fosse al 100% tuttavia la resa è del 40% quindi se da 100 moli ne ottengo 40 quante ne devo usare per avere 3,125 x109
100 :40 = X: 3,125 x109
X= 3,125 ∙109 (100/40) = 7,81 ∙107 moli
il volume viene calcolato ricordando che V = nRT/P quindi dai dati si ha:
V = nRT/P = (7,81 ∙107 ∙ 0,0821 ∙ 273)/1 = 1,7 ∙109 L.
risposta corretta A
34. SAPENDO CHE UN RECIPIENTE CONTIENE 66 g DI CO2 E 16 g DI O2 ALLA PRESSIONE DI 10,0 ATM, STABILIRE LA PRESSIONE PARZIALE DEL DIOSSIDO DI CARBONIO.
a) 8,0 atm b) 7,5 atm c) 5,0 atm d) 6,0 atm
SOLUZIONE
la frazione molare per due diverse sostanze gassose A e B viene espressa con la formula
Fm A= moli A / moli A + moliB
Fm B= moli B / moli A + moliB
moli CO2 = 66/44 = 1,5 moli
moli di O2 = 16/32 = 0,5 moli
la frazione molare di CO2 = 1,5/ 1,5 + 0,5 = 1,5/2 = 0,75
a frazione molare di O2 = 0,5/ 1,5 + 0,5 = 0,5/2 = 0,25
la pressione parziale di CO2 e di O2 è: pressione parziale = frazione molare x pressione totale quindi
pressione parziale CO2 = fraz.mol.di CO2 x Ptot = 0,75 ∙10 = 7,5 Atm.
(Ovviamente la pressione parziale O2 = fraz.mol.di O2 x Ptot = 0,25 ∙10 = 2,5 Atm)
risposta corretta B
35. IL FUNZIONAMENTO DEI PRIMI AIRBAG MONTATI SULLE AUTOMOBILI ERA BASATO SULLA REAZIONE DI DECOMPOSIZIONE DELL’AZIDE DI SODIO DESCRITTA DALLA SEGUENTE EQUAZIONE CHIMICA NON BILANCIATA:
NaN3→ Na + N
STABILIRE QUANTO REAGENTE È NECESSARIO PER PRODURRE 16,0 L DI AZOTO MISURATI ALLA TEMPERATURA DI 17 °C E ALLA PRESSIONE DI 1,20 ATM.
A) 52,4 G B) 78,6 G
C) 35,0 G
D) 157 G
soluzione
la reazione bilanciata è 2NaN3→ 2Na + 3N2
da questa reazione si vede che da 2 moli di NaN3 si ottengono 3 moli di N2
16 litri di azoto a 17° C e 1,2 Atm corrispondono a moli n= PV/RT quindi T=273+17 = 290 K e P= 1,2 Atm quindi
n= 1,2 x 16 / 0,0821 x 290 = 0,806 3 moli
pertanto se da 2 moli si ottengono 3 moli di N3 X moli daranno 0,803ì63 moli di N2
2:3 = X : 0,8063 X= 0,5376 moli di NaN3
i grammi si ottengono da moli=g/PM quindi g= 0,5376 x 65 =34,94 g di NaN3 sono necessari per produrre 16 litri di azoto a 17°C e 1,2 Atm
risposta corretta C
36. PER LO IONE CARBONATO, CO32‒, STABILIRE QUALI DELLE SEGUENTI AFFERMAZIONI SONO CORRETTE:
1. I TRE LEGAMI CARBONIO-OSSIGENO HANNO TUTTI LA STESSA LUNGHEZZA
2. UN ATOMO DI OSSIGENO NON HA CARICA, MENTRE GLI ALTRI DUE ATOMI DI OSSIGENO HANNO UNA CARICA NEGATIVA CIASCUNO
3. TUTTI E TRE GLI ANGOLI DI LEGAME SONO DI 120°
A) 1 e 3
B) 2 e 3
C) 1 e 2
D) NESSUNA DELLE AFFERMAZIONI È CORRETTA
soluzione
lo ione ha tre strutture possibili in cui gli elettroni si distribuiscono in modo uguale su tutti gli atomi ibridi SP2
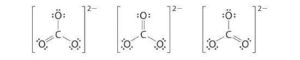
i tre legami C-O, sono quindi equivalenti e hanno la stessa lunghezza .
risposta corretta A
37. Indicare la molecola che ha una geometria piramidale.
A) PCl3
B) BCl 3
C) IF 3
D) SO3
soluzione
PCl3 (geometria piramidale trigonale),
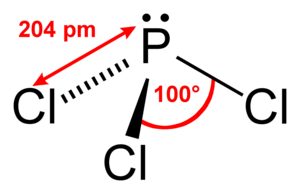
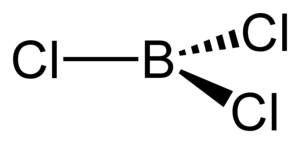
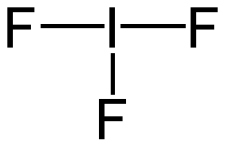
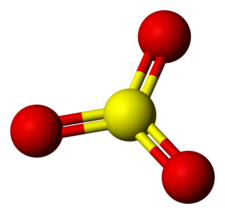
risposta corretta A
38. CALCOLARE LA PRESSIONE ESERCITATA DA 1,00 ∙1021 MOLECOLE DI UN GAS IN UN RECIPIENTE DI 3900 ml a 15,0 °C.
A) 6,1 ∙1021 atm B) 5,2 ∙10‒4 atm C) 1,0 ∙10‒5 atm D) 0,01 atm
SOLUZIONE
bisogna prima trasformare il numero di molecole in moli. Ciò è possibile ricordando che
MOLI = NUMERO DI MOLECOLE / COSTANTE DI AVOGADRO
MOLI = 1,00 X 1021/ 6,02 X 1023= 1,66 X 10-3
LA PRESSIONE SI CALCOLA DALL’ EQUAZION DI STATO GENERALE DEI GAS
P = nRT/V in cui T in gradi K = t° + 273 quindi T= 288 K
P = (1,66 ∙10‒3 ∙ 0,0821 ∙ 288)/3,9 = 0,01 atm.
risposta corretta D
39. FACENDO REAGIRE 10,0 L DI SICL4 GASSOSO, MISURATI A 127 °C E A 2,00 ATM, CALCOLARE LA MASSA IN GRAMMI DI HCL CHE SI OTTIENE IN BASE ALLA SEGUENTE EQUAZIONE CHIMICA NON BILANCIATA:
SICl4 + H2O → SIO2 + HCl
A) 88,8 g B) 22,2g
C) 44,4 g D) 280,0 g
la reazione bilanciata è : SICL4 + 2 H2O → SIO2 + 4 HCL
T= 273 + 127 = 400 K. P= 2 atm V= 10 litri
da questi dati possiamo ottenere le moli di SiCl4 ricordando che n = PV/RT
n = PV/RT = (2 ∙ 10)/(0,0821 ∙ 400)
n = 0,609 moli
dalla reazione bilanciata vediamo che per 1 mole di SiCl4 si ottengono 4 moli di HCl
pertanto le moli di HCl sono 4 x 0,609 =2,436 mol
per calcolare i grammi di HCl basta moltiplicare le moli per il PM che è 36,48
g HCl = 2,436 x 36,48= 88,8 g.
risposta corretta A
40. PER LA REAZIONE FRA IL COMPOSTO A E IL COMPOSTO B SONO STATI RACCOLTI I DATI RIPORTATI IN TABELLA; IN BASE AD ESSI STABILIRE L’ORDINE PARZIALE DI REAZIONE RISPETTO AL REAGENTE A E AL REAGENTE B
[A]INIZIALE [B] INIZIALE VEL. INIZIALE (MOL L ‒1) (MOL L‒1) (MOL L ‒1 S‒1)
0,20 0,20 600
0,60 0,20 1800
0,60 0,80 28800
A) SECONDO ORDINE RISPETTO AD A E SECONDO ORDINE RISPETTO A B
B) PRIMO ORDINE RISPETTO AD A E PRIMO ORDINE RISPETTO A B
C) PRIMO ORDINE RISPETTO AD A E SECONDO ORDINE RISPETTO A B
D) ORDINE ZERO RISPETTO AD A E SECONDO ORDINE RISPETTO A B
SOLUZIONE
Data la reazione generica
A → B
se consideriamo il reagente A, man mano che la reazione procede , cioè col passar del tempo t la quantità di A e quindi la sua concentrazione diminuisce ed è evidente che la velocità dipende dalla sua concentrazione.
Matematicamente si scrive V = – Δ [ A ]1 / Δt
se l’intervallo di tempo Δt tende a 0 allora la velocità rappresenta la velocità della reazione in un particolare istante cio significa che la velocità è il limite a cui tende il rapporto Δ [ A ] / Δt cioè la velocità istantanea sarà la derivata di [ A ] rispetto a dt, cioè
Essa èrappresentata dall’equazione:
V = – d [ A ]1 / dt = K1 [ A ]1
il segno negativo indica che [ A ] diminuisce nel tempo. Il numero 1 sta ad indicare l’esponente della concentrazione di A e questo rappresenta l’ordine di reazione
ovviamente all’inizio della reazione il tempo sarà t =0 e per conoscere la velocità dopo che il tempo trascorrerà e diventerà t dovremo sommare tutte le velocità che vanno dal tempo t=0 al tempo t e questo matematicamente significa fare l’integrale dal tempo t=0 al tempo t
V = ∫ – d [ A ] / [ A ] = K1 . ∫dt = ln [ A ]0 / [ A ]t = K1 (t – t0) = ln[ A ]0 – ln [ A ]t= K1 (t – t0)
dove [A ]0 rappresenta la concentrazione iniziale del reagente A e [A ]t è quella al tempo t.
se consideriamo la reazione 2A → B
la sua velocità potrà essere espressa dall’equazione:
V = – d [ A ] / dt = K2 [ A ]2
Che integrata tra il tempo t = zero e t = t diviene
∫ – d [ A ] / [ A ]2= K2 . ∫ dt = 1 / [ A ]t – 1 / [ A ]0 = K2 (t – t0)
questa è una velocità di secondo ordine poichè dipende dal quadrato della concentrazione di A cioè [ A ]2
L’esponente della concentrazione che compare nella legge di velocità si chiama ordine della reazione.
Si noti che l’ordine di reazione si determina solo sperimentalmente per ogni reazione.
può succedere che una specie si decomponga a velocità costante fino alla definitiva scomparsa.
Tale decomposizione è un esempio di reazione di ordine zero, la cui velocità è del tutto indipendente dalla concentrazione.
Le reazioni di ordine zero ordine zero procedono alla stessa velocità fino a quando non si siano consumati i reagenti, poi si arrestano bruscamente.
• Le si definisce di ordine zero perché:
Velocità =k [reagente]0
valutiamo adesso i dati sperimentali forniti dal quesito.
[A]iniziale [B]iniziale vel. iniziale
(mol L‒1) (mol L‒1 ) (mol L‒1 s‒1)
0,20 0,20 600
0,60 0,20 1800
0,60 0,80 28800
osserviamo che la [A] varia da 0,2 (mol L‒1)a 0,6 (mol L‒1) e la sua velocità varia da 600 a 1800 (mol L‒1 s‒1)
Vediamo che la velocità di reazione varia in modo diretto col variare della concentrazione di A MENTRE B RIMANE COSTANTE
V=K [A]
questo significa che
LA VELOCITA’ DI REAZIONE RISPETTO AD A E’ DEL PRIMO ORDINE
dai dati osserviamo inoltre che [A] rimane costante (0,6) mentre [B] è 80 cioè 4 volte la concentrazione iniziale con una velocità pari a 28800
questo dato indica che la velocità è proporzionale a [B] 2
V= K [B] 2
LA VELOCITA’ DI REAZIONE RISPETTO B E’ DEL SECONDO ORDINE
risposta corretta C
41. DOPO AVERE CALCOLATO IL RAPPORTO PONDERALE TRA ALLUMINIO (MM = 26,98 g/mol), ZOLFO (MM = 32,07 g/mol) E OSSIGENO (MM = 16,00 g/mol), INDICARE LA PERCENTUALE IN PESO DI CIASCUNO DI ESSI NEL SOLFATO DI ALLUMINIO (MM AL2 (SO4 )3 = 342,17 g/mol).
A) AL = 15,77%; S = 44,18%; O = 40,05%
B) AL = 15,77%; S = 28,12%; O = 56,11%
C) AL = 31,54%; S = 13,69%; O = 23,08%
D) AL = 7,85%; S = 23,55%; O = 68,60%
SOLUZIONE
se in AL2 (SO4 )3 vi sono 2 Al = 100 : X X= 26,98 x 2 x 100 / 342,17 = 3,96/342,17 = 15,77%.
se in AL2 (SO4 )3 vi sono 3 S = 100 : X X= 32,07 ∙ 3 x 100 / 342,17 = 96,21 /342,17 = 29,12 %
se in AL2 (SO4 )3 vi sono 12 O= 100: X X = 16 ∙x 12 x 100 /342,17 = 192 /342,17 = 56,11%.
risposta corretta B
42. CALCOLARE IL PRODOTTO DI SOLUBILITÀ DI MgF2 (MM = 62,32 g/mol) SAPENDO CHE QUESTO COMPOSTO HA UNA
SOLUBILITÀ IN ACQUA DI 74,78 mg /l
A) 1,72 ∙10‒9 (MOL/L)3
B) 6,91 ∙10‒9 (MOL/L)3
C) 6,91 ∙10‒5 (MOL/L)3
D) 1,72 ∙10‒6 (MOL/L)3
SOLUZIONE
LA REAZIONE DI DISSOCIAZIONE È: MgF2 → Mg+2 +2F–
da cui Kps = [Mg2+][F‒]2
indicando con S la solubilità di Mg2+ avremo Kps = [Mg2+][F‒]2 = S ∙(2S)2 = 4S3
la solubilità deve essere espressa in moli/l per cui 74,78/1000 = grammi e quindi essendo 62,3 il PM si ha
S= 74,78 ∙10‒3/62,3 = 1,2 ∙10‒3 mol/l
Kps = 4S3= 4 x (1,2 x 10-3 )3 = 6,92 ∙10-9 moli/l
risposta corretta B
43. INDICARE LA FORMULA MINIMA DI UN COMPOSTO CHE HA DATO ALL’ANALISI I SEGUENTI RISULTATI: C = 76,93%; H = 5,12%; N = 17,95%
A) C5H4N
B) C5H3N
C) C4H3N
D) C2H2N
SOLUZIONE
calcoliamo le moli di ogni elemento :
C (76,93/12 = 6,4 mol),
H (5,12/1,008 = 5,08 mol),
N (17,95/14 = 1,28 mol).
dividiamo per il numero più piccolo di moli e d avremo :
C 6,40/1,28 = 5
H 5,08/1,28 = 4
N 1,28/1,28 = 1
La FORMULA MINIMA del composto è quindi : C5H4N.
risposta corretta A
44. STABILIRE I COEFFICIENTI STECHIOMETRICI DELLA SEGUENTE REAZIONE:
NaAl(OH)4 + H2SO4 → Na2SO4 + Al2(SO4)3 + H2O
A) 1, 2, 2, 2, 4 B) 2, 3, 1, 1, 4 C) 2, 4, 1, 1, 8 D) 1, 3, 2, 2, 4
soluzione
per bilanciare la reazione, consideriamo Al : di questo elemento a dx vi sono 2 atomi ( Al2(SO4)3) mentre a Sx è presente 1 solo atomo quindi dobbiamo aumentare a 2 la molecola di NaAl(OH)4
Consideriamo adesso il gruppo Solfato SO4: a dx vi sono 3 gruppi in Al2(SO4)3 ed 1 in Na2 SO4 (in totale a Sx vi sono 4 gruppi SO4) mentre a Sx nessuno per cui a Sx dobbiamo aumentare a 4 H2SO4 per bilanciare SO4
gli atomi di H a Sx sono adesso sono diventati 8 da H2SO4 e 2×4 =8 provenienti da 2 NaAl(OH)4 e a Dx 1 quindi in totale a Sx abbiamo 16 atomi di H quindi a Dx dobbiamo moltiplicare H2O per 8 per bilanciare i 16 atoni di H a Sx
ne consegue che la reazione bilanciata è:
2 NaAl(OH)4 +4 H2SO4 → Na2SO4 + Al2(SO4)3 + 8H2O
risposta corretta C
45. INDICARE IL PH DI UNA SOLUZIONE DI IDROSSIDO DI BARIO 3,0 ∙10‒3 mol/l
A) 11,78 B) 10,03
C) 9,80
D) 3,50
Essendo l’idrossido di Ba una BASE FORTE Ba(OH)2 rilascia i due gruppi OH– in soluzione secondo la reazione di dissociazione
Ba(OH)2 →Ba+2+ 2 OH‒
poichè si tratta di una base forte OH- = 2 volte la concentrazione iniziale
[OH‒] = 2C = 2 ∙ 3,0 ∙10‒3 = 6,0 ∙10‒3 M
per poter calcolare il PH ricordiamo che PH+POH =14
PH=14 – POH
POH= -log 6,0 ∙10‒3
POH = 3-log 6,0 = 3-0,78 = 0,22
PH= 14 – POH = 14 – 0,22 = 11,78
risposta corretta A
46. INDICARE LA CONCENTRAZIONE MOLARE DI UNA SOLUZIONE DI PEROSSIDO DI IDROGENO (MM = 34,02 g/mol) AL 30%m/m (D = 1,1g/mol ).
A) 4,90 MOL/L B) 0,979 MOL/L C) 3,26 MOL/L D) 9,79 MOL/L
SOLUZIONE
in questa soluzione vi è il 30% di una mole di H2O2 quindi vi sono 30 /34,2 moli = 0,8818 moli
però essendo la densità 1,1 g/mol in realtà vi sono 0,8818 x 1,1 moli = 0.979 moli
il calcolo che abbiamo fatto si riferiva alle quantità in 100 g ( la soluzione è al 30%)
ma siccome la molarità è espressa in moli/litro è evidente che se in 100 vi sono 0,979 moli in 1000 ve ne sono 0,979 x 1000 / 100 = 9,79 moli/l
in 1 litro vi sono quindi 0,979 x
risposta corretta D
47. IL CLORURO DI CALCIO È UN SALE ESTREMAMENTE SOLUBILE IN ACQUA. SAPENDO CHE LA SUA ENTALPIA DI SOLVATAZIONE IN ACQUA È Hsolv = ‒81,3 KJ/mole A 25 °C INDICARE L’AFFERMAZIONE CHE RAZIONALIZZA QUESTO FENOMENO:
a) il cloruro di calcio si solvata facilmente perché il ΔG°solv= 298 > 0 grazie al carattere esotermico della sua reazione di idratazione in soluzione
b) il cloruro di calcio si solvata facilmente perché il ΔsolvG°298 < 0, reazione sostenuta dalla esotermia del processo di idratazione
c) il cloruro di calcio si solvata facilmente perché il ΔsolvG°298 < 0 giacché l’entropia del processo di idratazione in soluzione è negativa e compensa l’endotermia della reazione
d) il cloruro di calcio non si solvata facilmente in soluzione perché il ΔsolvH°298 < 0 47.
SOLUZIONE
ΔG°solv 298 < 0. sappiamo che ∆G = ∆H ‒T∆S.
il cloruro di calcio CaCl2 si solvata facilmente perché ΔG < 0 .Dalla relazione scritta sopra si può notare che il valore di ∆G< 0 è dovuto ad un aumento di ΔS > 0 in quanto i sali poco solubili possiedono tutti un ΔS > 0
risposta corretta B
48. IL NEON È UN GAS NOBILE MONOATOMICO RARO NELL’ATMOSFERA (È PRESENTE IN 1 PARTE PER 65000). LA SUA MASSA MOLARE ATOMICA È 20,179 G/MOL MENTRE LA MASSA MOLARE MEDIA DEI COMPONENTI DELL’ARIA È 28,96 G/MOL. DAL CONFRONTO DELLA DENSITÀ DEL NEON (DNE) CON LA DENSITÀ MEDIA DELL’ARIA (DAIR) IN CONDIZIONI STANDARD (1 BAR A 25 °C) È POSSIBILE VALUTARE COME SI STRATIFICA IL NEON NELL’ATMOSFERA TERRESTRE.
A) DNe > DAIR e quindi il neon si accumula negli strati più interni dell’atmosfera
B) DNe < DAIR e quindi il neon si accumula negli strati più esterni dell’atmosfera
C) DNe > DAIR e quindi il neon si accumula negli strati più esterni dell’atmosfera
D) DNe < DAIR e quindi il neon si accumula negli strati più interni dell’atmosfera
SOLUZIONE
il neon Ne (20,2 g/mol) è più leggero dell’ossigeno O (32 g/mol) e anche dell’azoto N (28 g/mol), quindi è meno denso dell’aria
(DNe < DAIR) e tende a stare nella parte superiore dell’atmosfera pertanto il neon si accumula negli strati più esterni dell’atmosfera.
risposta corretta C
